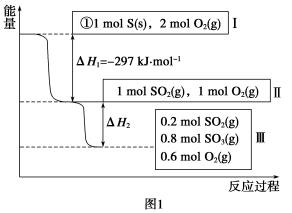
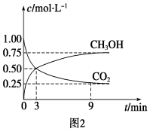
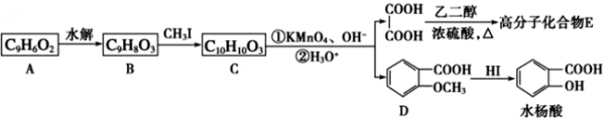
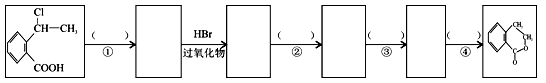
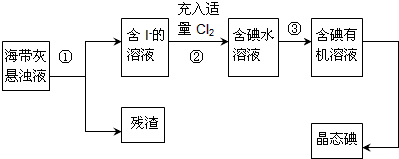
-
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e- =O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水的电离方程式为H3PO2
H++ H2PO2-
难度: 中等查看答案及解析
-
下列关于物质性质变化的比较,不正确的是
A. 稳定性:HI>HBr>HCl>HF B. 原子半径大小:Na>S>O
C. 碱性强弱:KOH>NaOH>LiOH D. 还原性强弱:Cl﹣<Br﹣<I﹣
难度: 简单查看答案及解析
-
绿原酸的结构简式如图,下列有关绿原酸的说法错误的是
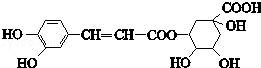
A.分子式为C16H18O9
B.能与NaHCO3反应
C.能发生取代反应、氧化反应和消去反应
D.1 mol绿原酸最多与6 mol Br2反应
难度: 中等查看答案及解析
-
由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出.将气体通过足量的NaOH溶液,气体体积减少一部分.将上述混合物在空气中加热,有气体放出,下列判断正确的是(注:2Na2O2+2H2O=4NaOH+O2↑)
A.混合物中一定不含有Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
难度: 困难查看答案及解析
-
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是
已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

A.碳棒上
发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
难度: 困难查看答案及解析
-
下列坐标图均涉及平衡原理,其中相关表述正确的是

A.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性
B.图②表示2SO2(g)+O2(g)
2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
C.图③表示反应2NH3(g)
3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D.图④表示AgCl(s)
Ag+(
aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
难度: 困难查看答案及解析
-
.在铁和氧化铁混合物15 g中,加入稀硫酸150 mL,能放出H2 1.68 L(标准状况)。同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化。为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3 mol
·L-1的NaOH溶液200 mL,则原硫酸的物质的量浓度是
A.1.5 mol·L-1 B.2 mol·L-1 C.2.5 mol·L-1 D.3 mol·L-1
难度: 困难查看答案及解析