-
下列说法正确的是( )
A. 1s轨道的电子云形状为圆形的面
B. 2s的电子云半径比1s电子云半径大,说明2s能级的电子比1s的多
C. 电子在1s轨道上运动像地球围绕太阳旋转
D. 4f能级中最多可容纳14个电子
难度: 中等查看答案及解析
-
以下能级符号不正确的是( )
A. 3s B. 3f C. 3d D. 3p
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A. 石英的分子式:SiO2
B. NH4Cl 的电子式:
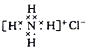
C. 基态碳原子的价电子轨道表示式为
D. Cr原子的基态简化电子排布式为3d54s1
难度: 简单查看答案及解析
-
若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了( )
A. 能量守恒原理 B. 泡利不相容原理 C. 洪特规则 D. 能量最低原理
难度: 简单查看答案及解析
-
下列物质属于分子晶体的是( )
A. 熔点是10.31℃,液态不导电,水溶液能导电
B. 熔点是1070℃,固态不导电,熔融状态能导电,易溶于水
C. 熔点3550℃,不溶于水,不导电
D. 熔点是97.80℃,质软,固态可导电,密度是0.97g·cm﹣3
难度: 简单查看答案及解析
-
下列各组元素都属于p区的是( )
A. 原子序数为1,6,10的元素 B. N,S,P
C. Fe,Cr, Cl D. Na,Li,Mg
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是( )
A. 元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6
B. 若某基态原子的外围电子排布为4d25s2,它是第五周期IVB族元素
C. M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
难度: 中等查看答案及解析
-
下面有关晶体的叙述中,不正确的是 ( )
A. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
B. 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
C. 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构
D. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
难度: 中等查看答案及解析
-
X、Y、Z三种元素的原子,其最外层电子排布为ns1 , 3s23p1和2s22p4 ,由这三种元素组成的化合物的化学式可能是( )
A. X2YZ3 B. XYZ2 C. X2YZ2 D. XYZ3
难度: 中等查看答案及解析
-
下列组合不能形成配位键的是( )
A. Ag+、NH3 B. H2O、H+ C. Cu2+、H+ D. Fe3+、CO
难度: 中等查看答案及解析
-
某些物质的熔点数据如下表,据此做出的下列判断中错误的是( )
Na2O
NaCl
AlF3
AlCl3
920℃
801℃
1291℃
190℃
BCl3
SO2
CO2
SiO2
-107℃
44.8℃
-57℃
1723℃
A. 表中BCl3和CO2均是分子晶体
B. 同族元素的氧化物可形成不同类型的晶体
C. 只要由金属元素和非金属元素形成的晶体就一定是离子晶体
D. 不同族元素的氧化物可形成相同类型的晶体
难度: 中等查看答案及解析
-
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于CsCl晶体结构的图象是( )
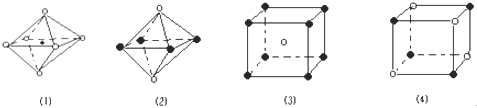
A. 图(1)和图(3) B. 只有图(3)
C. 图(2)和图(3) D. 图(1)和图(4)
难度: 中等查看答案及解析
-
四种短周期元素W、X、Y、Z的原子序数依次增大。其原子的最外层电了数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-的电子数之差为8。下列说法不正确的是( )
A. WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
B. 元素原子半径从大到小的顺序是X、Y、Z
C. W与Y通过离子键形成离子化合物
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是元素Z
难度: 中等查看答案及解析
-
下列物质的分子中既有σ键,又有π键,并含有非极性键的是( )
①H2O2 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2
A. ②⑤⑥ B. ①②⑤⑥
C. ②④⑥ D. ②③④
难度: 中等查看答案及解析
-
下列有关性质的比较中,正确的是( )
A. 硬度:白磷>冰>二氧化硅
B. 金属原子化热:Na>Mg>Al
C. 键的极性:N﹣H<O﹣H<F﹣H
D. 熔点:

难度: 中等查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。
I1
I2
I3
I4
……
R
740
1500
7700
10500
……
下列关于元素R的判断中一定正确的是( )
A. R元素的原子最外层共有4个电子
B. R的最高正价为+3价
C. R元素基态原子的电子排布式为1s22s2
D. R元素位于元素周期表中第ⅡA族
难度: 中等查看答案及解析
-
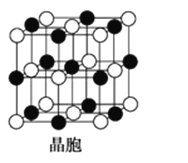
如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的钡原子数和这种晶体材料的化学式分别是(各原子所带电荷均已略去)( )
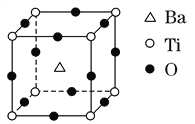
A. 8;BaTi8O12 B. 8;BaTiO3
C. 6;BaTiO3 D. 3;BaTi2O3
难度: 中等查看答案及解析
-
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下表中的数据,不能形成合金的是 ( )
Na
Cu
Al
Fe
熔点/℃
97.8
1083
660
1535
沸点/℃
883
2567
2467
2750
A. Cu和Al B. Fe和Cu C. Al和Na D. Cu和Na
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
难度: 中等查看答案及解析
-
以 NA表示阿伏加德罗常数的值,下列说法正确的是( )
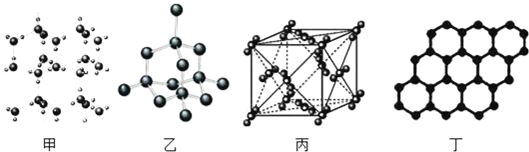
A. 18g 冰(图甲)中含 O﹣H 键数目为 4NA
B. 28g 晶体硅(图乙)中含有σ键数目为 4NA
C. 44g 干冰(图丙)中含有 0.25NA个晶胞结构单元
D. 石墨烯(图丁)是碳原子单层片状新材料,12g 石墨烯中含π键数目为 1.5NA
难度: 中等查看答案及解析