-
下列与化学反应能量变化相关的叙述正确的是
A.生成物能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
难度: 简单查看答案及解析
-
下列变化过程中,需要吸热的是
A.生石灰与水混合 B.天然气燃烧 C.浓硫酸溶于水 D.干冰气化
难度: 简单查看答案及解析
-
从手册上查得:H-H、Cl-Cl和 H-Cl的键能分别为436、243和431 kJ·mol-1,请用此数据估计,由Cl2、H2生成1molH-Cl 时的热效应
A放热183 kJ·mol-1 B放热91.5kJ·mol-1 C吸热183kJ·mol-1 D吸热91.5kJ·mol-1
难度: 简单查看答案及解析
-
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(S)+3B(g)
2C(g)+D(g)已达平衡状态的是
A.混合气体的压强不随时间变化 B. B的生成速率和D的消耗速率为3︰1
C.混合气体的密度不随时间变化 D. B、C、D的分子数之比为3︰2︰1
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.对于同一物质在不同状态时的熵值是:气态>液态>固态
B.焓变小于0的反应肯定是自发的
C.熵变大于0的反应肯定是自发的
D.自发反应的反应速率肯定很快
难度: 简单查看答案及解析
-
下列化学反应中,为使平衡体系析出更多的银,可采取的措施是Ag++Fe2+
Ag(固)+Fe3+(正反应放热)
A常温下加压 B增加Fe3+的浓度
C增加Fe2+的浓度 D移去一些析出的银
难度: 简单查看答案及解析
-
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)=zC(g);△H<0,达到平衡后测得A气体的浓度为0.5mol·L-;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3mol·L-。则下列叙述正确的是
A.平衡向右移动 B.x+y>z C.B的转化率提高 D.C的体积分数增加
难度: 简单查看答案及解析
-
在1L容器中含有2amolH2和2amolN2,设法使其反应并达到平衡,测得N2的转化率为20%,此时H2的浓度是
A、0.4amol·L-1 B、0.8amol·L-1 C、1.6a mol·L-1 D、1.8a mol·L-1
难度: 简单查看答案及解析
-
在一个密闭容器中用等物质量的A和B发生如下的反应:A(g)+2B(g)
2C(g) 达到平衡时若A和B的物质的量之和与C的物质的量相等,则此时A的转化率为
A 50% B 60% C 40% D 70%
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是
A.加少量CH3COONa固体 B.加水
C.不用稀硫酸,改用98%浓硫酸 D.不用铁片,改用铁粉
难度: 简单查看答案及解析
-
一定条件下反应mA(g)+ nB(g)
pC(g)+ qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是
A.2、6、3、5 B.3、1、2、2 C.3、1、2、1 D.1、3、2、2
难度: 简单查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
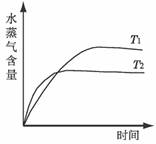
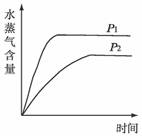
温度(T)的影响 压强(p)的影响
A.CO2(g)+2NH3(g)
CO(NH2)2(s) + H2O(g);△H<0
B.CO2(g)+ H2(g)
CO(g) + H2O(g);△H>0
C.CH3CH2OH(g)
CH2=CH2(g) + H2O(g);△H>0
D.2C6H5CH2CH3(g) + O2(g)
2C6H5CH=CH2(g) + 2 H2O(g);△H<0
难度: 简单查看答案及解析
-
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A. c(H+) B. Ka(HF) C.
D.
难度: 简单查看答案及解析
-
取浓度相同的Na0H和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol/L B.0.017mol/L C.0.05mol/L D.0.50mol/L
难度: 简单查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH-;ΔH>0,下列叙述正确的是
A、向水中加人稀氨水,平衡逆向移动,c(OH―)降低
B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C、向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低
D、将水加热,Kw增大,pH不变
难度: 简单查看答案及解析
-
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应CO+H2O(g)
CO2+H2当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分子大于x的是
A、0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2
B、1mol CO+1mol H2O(g)+1mol CO2 +1mol H2
C、0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2
D、0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2
难度: 简单查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是
A、 pH=3的盐酸和pH=11的氨水等体积混合
B、 pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C、 pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合
D、 pH=3的硫酸和pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
对于反应A2(g) + 2B2(g)
2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是

难度: 简单查看答案及解析
-
若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为
(A)10(a+b-12)% (B)10(a+b-14)% (C)10(12-a-b)% (D)10(14-a-b)%
难度: 简单查看答案及解析
