-
可以将反应Zn+Br2=ZnBr2设计成可充电电池,下列4个电极反应①Br2+2e-=2Br- ②2Br--2e-=Br2 ③Zn-2e-=Zn2+ ④Zn2++2e-=Zn其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③
B.②和①
C.③和①
D.④和①难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H1=△H2=△H3
D.△H2<△H3<△H1难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体总物质的量增大的方向移动;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A.①④
B.①②③
C.②③④
D.①②③④难度: 中等查看答案及解析
-
下列过程一定释放出能量的是( )
A.化合反应
B.分解反应
C.分子拆成原子
D.原子组成分子难度: 中等查看答案及解析
-
把Ca(OH)2固体放入一定量的蒸馏水中,有 Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
A.溶液中Ca2+数目增多
B.溶液中c(Ca2+)增大
C.溶液pH值不变
D.溶液pH值增大难度: 中等查看答案及解析
-
已知0.1mol•L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
相同材质的铁在下列情形下最不易被腐蚀的是( )
A.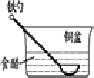
B.
C.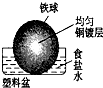
D.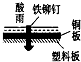
难度: 中等查看答案及解析
-
可逆反应N2+3H2⇌2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v正(NH3)
C.v正(H2)=3v逆(NH3)
D.3v正(N2)=v逆(H2)难度: 中等查看答案及解析
-
现代大爆炸理论认为:天然元素源于氢氦等发生的原子核的融合反应.这于一百多年前,普鲁特运用思辨性推测作出“氢是所有元素之母”的预言,恰好“一致”.下列说法正确的是( )
A.科学研究中若能以思辨性推测为核心,就能加快科学的进程
B.普鲁特“既然氢最轻,它就是其他一切元素之母”的推理是符合逻辑的
C.“一致”是巧合,普鲁特的预言没有科学事实和理论支撑,只是一种猜测
D.“现代大爆炸理论”是解释宇宙诞生的唯一正确的理论难度: 中等查看答案及解析
-
如图是温度和压强对X+Y⇌2Z 反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )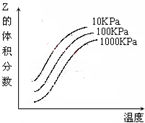
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的正反应的△H>0难度: 中等查看答案及解析
-
升高温度时,化学反应速率加快,主要是由于( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的难度: 中等查看答案及解析
-
下列各组离子因发生水解反应而不能大量共存的是( )
A.Ba2+、Cl-、Na+、SO42-
B.AlO2-、K+、HCO3-、Cl-
C.OH-、Fe3+、NO3-、SO42-
D.Al3+、Na+、HCO3-、Cl-难度: 中等查看答案及解析
-
原子核外P能层和p能级可容纳的最多电子数分别为( )
A.32和2
B.50和6
C.72和6
D.86和10难度: 中等查看答案及解析
-
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.上述电池工作时,有关说法正确的是( )
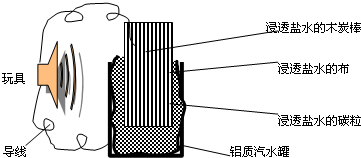
A.铝罐将逐渐被腐蚀
B.碳粒和炭棒上发生的反应为:O2+4e-=2O2-
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻难度: 中等查看答案及解析
-
对于化学反应能否自发进行,下列说法中不正确的是( )
A.若△H<0,△S>0,任何温度下都能自发进行
B.若△H>0,△S<0,任何温度下都不能自发进行
C.若△H>0,△S>0,低温时可自发进行
D.若△H<0,△S<0,低温时可自发进行难度: 中等查看答案及解析
-
根据下列电子排布,处于激发态的原子是( )
A.1s22s22p6
B.1s22s22p63s1
C.[Ar]3d14s2
D.1s22s23s1难度: 中等查看答案及解析
-
现有下列一些常见的仪器:
①大、小烧杯,②容量瓶,③量筒,④环形玻璃搅拌棒,⑤试管,⑥温度计,⑦蒸发皿,⑧托盘天平.
在测定稀盐酸和氢氧化钠稀溶液中和热的实验中,不需要使用的仪器有( )
A.①②⑥⑦
B.②⑤⑦⑧
C.②③⑦⑧
D.③④⑤⑦难度: 中等查看答案及解析
-
盐的水解程度大小可以用“水解度”来表示.关于NaA型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数.若测得2L1mol•L-1的强碱弱酸盐NaA溶液的pH为10,则A-离子(A-表示一元酸根离子)的水解度是( )
A.0.01%
B.0.1%
C.0.2%
D.1%难度: 中等查看答案及解析
-
一定温度下,下列叙述正确的是( )
A.向饱和AgCl水溶液中加入饱和NaCl溶液,c(Cl-)增大,AgCl的溶度积增大
B.将难溶电解质放入纯水中,溶解达平衡时,电解质离子的浓度的乘积就是该物质的溶度积
C.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,重新达到平衡时,AgCl的溶度积不变,其溶解度也不变
D.AgCl的Ksp=1.8×10-10mol2•L-2,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol2•L-2难度: 中等查看答案及解析
-
盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )

A.A→F,△H=-△H6
B.△H1+△H2+△H3+△H4+△H5+△H6=1
C.C→F,|△H|=|△H1+△H2+△H6|
D.|△H1+△H2+△H3|=|△H4+△H5+△H6|难度: 中等查看答案及解析
-
反应N2O4(g)═2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、B两点气体的颜色:A深,B浅
C.T1>T2
D.A、C两点气体的平均相对分子质量:A>C难度: 中等查看答案及解析
-
在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe由+2价转为+3价
②O2被还原、
③产生H2、
④Fe(OH)3失水形成Fe2O3•xH2O、
⑤杂质碳被氧化.
A.①②③④
B.只②③④
C.只①②
D.①②③④⑤难度: 中等查看答案及解析
-
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混合,则混合液中微粒浓度关系正确的是( )
A.c (CH3COO-)>c (Na+)
B.c (CH3COOH)+c (CH3COO-)=0.02mol/L
C.c (CH3COOH)>c (CH3COO-)
D.c (OH-)>c (H+)难度: 中等查看答案及解析
-
将 1mol SO2和 1mol O2 通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量是( )
A.0.3mol
B.0.15mol
C.小于 0.15mol
D.大于0.15mol而小于 0.3mol难度: 中等查看答案及解析
-
新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠.已知该电池放电时,正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+.下列说法中正确的是( )
A.充电时动力电池上标注“+”的电极应与外接电源的正极相连
B.充电时电池反应为FePO4+Li++e-=LiFePO4
C.放电时电池内部Li+向负极移动
D.放电时,在正极上Li+得电子被还原难度: 中等查看答案及解析