-
决定化学反应速率的主要因素是
A.反应物的浓度 B.反应温度 C.使用催化剂 D.反应物的性质
难度: 简单查看答案及解析
-
下列说法中正确的是
A.熵增加且放热的反应一定是自发反应
B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应
C.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
D.非自发反应在任何条件下都不能发生
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0
B.铁片镀锌时,铁片与外电源的正极相连
C.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)⇌NO(g)+SO3(g),通入少量O2,
的值及SO2转化率不变
难度: 困难查看答案及解析
-
在一定条件下发生反应2A(g)===2B(g)+C(g),将2 mol A通入2 L容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A的物质的量为0.8 mol。用B的浓度变化来表示该反应的速率为
A.0.24 mol/(L·min) B.0.08 mol/(L·min)
C.0.06 mol/(L·min) D.0.12 mol/(L·min)
难度: 中等查看答案及解析
-
对于可逆反应A(g)+3B(s)
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
难度: 中等查看答案及解析
-
在一定条件下,可逆反应N2(g)+3H3(g)
2NH3(g) ΔH<0达到平衡,当单独改变下列条件后,有关叙述错误的是
A.加催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等
B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数
D.加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
难度: 中等查看答案及解析
-
有一处于平衡状态的反应:X(s)+3Y(g)
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A.30~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度, 40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
难度: 中等查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
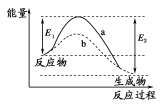
A.a与b相比,b的活化能更高
B.反应物断键吸收的总能量小于生成物成键释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,a的反应速率更快
难度: 中等查看答案及解析
-
某温度下,C和水在密闭容器中发生下列反应:C(s)+H2O(g)
CO(g)+H2(g),CO(g)+H2O(g)
CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为
A.0.1 mol/L B.0.9 mol/L C.1.8 mol/L D.1.9 mol/L
难度: 中等查看答案及解析
-
已知298.15 K时,可逆反应:(aq)+Sn(s)
Pb(s)+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断
难度: 中等查看答案及解析
-
在溶液中,反应A+2B
C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200 mol·L-1、c(C)=0 mol·L-1。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
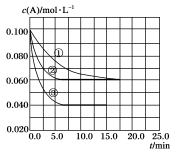
A.反应的平衡常数:①<②
B.反应A+2B
C的ΔH>0
C.实验②平衡时B的转化率为60%
D.实验③平衡时c(C)=0.040 mol·L-1
难度: 中等查看答案及解析
-
T℃时,将6 mol CO2和8mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是

A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0
C.曲线Ⅱ对应的条件改变是减小压强
D.T℃时,该反应的化学平衡常数为0.125
难度: 中等查看答案及解析
-
在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2
N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
A.平均反应速率A>B
B.平衡时NO2的物质的量B>A
C.平衡时NO2的转化率A>B
D.平衡时N2O4的物质的量B>A
难度: 中等查看答案及解析
-
在一定条件下,向某一密闭容器中,加入一定量的HI或加入一定量的PCl5,反应达到平衡后,在t时刻改变条件,其反应速率与时间的变化关系均可用下图表示。那么对于不同反应在t时刻改变条件的叙述正确的是

A.对于2HI(g)
I2(g)+H2(g)反应,t时刻保持温度和体积不变,再加入一定量的HI
B.对于2HI(g)
I2(g)+H2(g)反应,t时刻保持温度和压 强不变,再加入一定量的HI
C.对于PCl5(g)
PCl3(g)+Cl2(g)反应,t时刻保持温度 和体积不变,再加入一定量的PCl5
D.对于PCl5 (g)
PCl3(g)+Cl2(g)反应,t时刻保持温度和压强不变,再加入一定量的PCl3
难度: 中等查看答案及解析
-
羰基硫(COS)可作为一种××熏蒸剂,能防止某些昆虫、线虫和××的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=0.1。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
难度: 中等查看答案及解析
-
有反应CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
难度: 中等查看答案及解析
-
已知PCl5气体的分解反应为PCl5(g)
PCl3(g)+ Cl2 (g),在473K达到平衡时气态PCl5 有48.5%分解,在573K达平衡时气态PCl5 有97%分解,则此反应是
A.吸热反应
B.放热反应
C.反应的△H=0
D.无法判断是吸热反应还是放热反应
难度: 中等查看答案及解析
-
已知如下反应:2X(g)+Y(g)
2Z(g) ΔH<0在不同温度(T1和T2)及压强(p1和p2)下产物Z的物质的量n与反应时间t的关系如图所示,下列判断正确的是

A.T1<T2,p1<p2 B.T1>T2,p1>p2
C.T1<T2,p1>p2 D.T1>T2,p1<p2
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
难度: 困难查看答案及解析
-
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A
B


升高温度,平衡常数减小
0~3 s内,反应速率为v(NO2)=0.2 mol·L-1
C
D


t1时仅加入催化剂,平衡正向移动
达平衡时,仅改变x,则x为c(O2)
难度: 困难查看答案及解析
-
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
M(g)+N(g),所得实验数据如下表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
难度: 极难查看答案及解析
-
在450℃、5.05×107Pa时,如果把1体积N2和3体积H2的混合物通入一个装有催化剂的密闭容器中反应达到平衡时,得到含NH352%(体积分数)的混合气体。在同温同压下向密闭容器中通入2体积N2和6体积H2,达到平衡时NH3的体积分数为
A.大于52% B.等于52% C.小于52% D.不能确定
难度: 困难查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
难度: 困难查看答案及解析
-
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应: 2A(g)+B(g
3C(g)+D(g),达到平衡时C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是
A.4molA+2molB B.3molC+1molD+1molB
C.3molC+1molD D.1.5molC+0.5molD
难度: 困难查看答案及解析