-
几种短周期元素的原子半径及主要化合价见下表
根据表中信息,判断以下说法正确的是( )元素符号 X Y Z R T 原子半径(nm) 0.160 0.080 0.102 0.143 0.074 主要化合价 +2 +2 -2,+4,+6 +3 -2
A.单质与稀硫酸反应的速率快慢:R>Y>X
B.离子半径:Al(OH)3胶粒>O2->Mg2+>Al3+,
C.元素最高价氧化物的水化物的碱性:Y>R>X
D.单质与氢气化合的难易程度:Z>T难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2++2OH-+NH4++HSO4-=BaSO4↓+NH3•H2O+H2O
B.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C.向硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32-
D.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O难度: 中等查看答案及解析
-
物质发生化学反应时,下列量值在反应前后肯定不发生变化的是( )
A.物质的种类
B.原子总数
C.分子总数
D.物质所具有的总能量难度: 中等查看答案及解析
-
2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的
Fe原子,有关
Fe的说法正确的是( )
A.它是一种新元素
B.Fe与
Fe互为同素异形体
C.它是一种新原子
D.Fe的中子数是26
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
A.1L1mol•L-1的FeCl3溶液中含有NA个Fe3+
B.3.4gNH3中含N-H键数目为0.6NA
C.2.24LCO2与足量的Na2O2反应,Na2O2转移的电子总数一定为0.1NA
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是( )
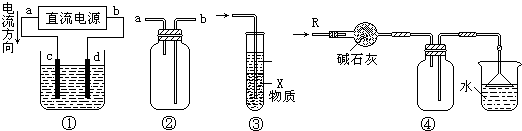
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,(NH3和HCl不溶于CCl4)并可防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3难度: 中等查看答案及解析
-
下列各组物质中,不能按
(“→”表示一步完成)关系相互转化的是( )
A.a物质:Fe; b物质:FeCl3;c物质:FeCl2
B.a物质:Cl2; b物质:NaClO;c物质:NaCl
C.a物质:Al; b物质:Al(OH)3;c物质:NaAlO2
D.a物质:Cu; b物质:CuSO4;c物质:CuCl2难度: 中等查看答案及解析