-
化学与科技、社会、生产、生活密切相关。下列有关说法不正确的是
A.用甲醛浸泡海鲜
B.棉花、木材和植物秸秆的主要成分都是纤维素
C.“地沟油”禁止食用,但可以用来制肥皂
D.浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用此物保鲜水果
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
A.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸
B.混合物:铝热剂、福尔马林、水玻璃、漂白粉
C.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
D.明矾、水银、烧碱、硫酸均为强电解质
难度: 简单查看答案及解析
-
能正确表示下列反应离子方程式的是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O
C.氢氧化镁与稀盐酸反应:H++OH-=H2O
D.Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.将0.1 molFeCL3溶液于1 L水中,所得溶液含Fe3+离子数目为0.1 NA
B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C.常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA
D.在高温下,有1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA
难度: 中等查看答案及解析
-
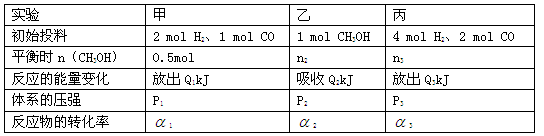
工业上消除氮氧化物的污染,可用如下反应: CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
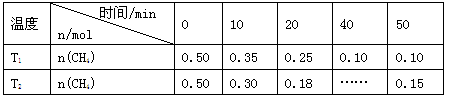
下列说法不正确的是
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a < 0
D.平衡常数:K(T1)<K(T2)
难度: 简单查看答案及解析
-
下列有关溶液中粒子浓度关系的比较中不正确的是
A.饱和氯水中滴加0.1 mol·L-1的NaOH溶液,溶液pH=7时:c(Na+)=2c(ClO-)+c(HClO)
B.已知HF的酸性比CH3 COOH的强,pH相等的NaF与CH3 COOK溶液中:c(Na+)-c(F-)=c(K+) -c(CH3COO-)
C.0.lmol/L pH为1的NaHB溶液中:c(Na+)>c(B2﹣)>c(H+)>c(OH﹣)
D.常温下,向20.00 mL 0.100 mol·L-1 NaA溶液中逐滴加入0.100 mol·L-1盐酸溶液的pH=7时:c(HA)=c(Cl-)>c(OH-)=c(H+)
难度: 中等查看答案及解析