-
化学与人类生活密切相关,下列说法正确的是
A. 为减少木材的使用,使用聚氯乙烯生产包装盒
B. 化学药品着火,都要立即用水或泡沫灭火器灭火
C. 水玻璃可用于生产黏合剂和防火剂
D. 煤的干馏和石油的分馏都属于化学变化
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列有关叙述正确的是
A. 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA
B. 足量的Fe粉与1molCl2充分反应转移的电子数为2NA
C. 1.2 g NaHSO4晶体中含有离子总数为0.03 NA
D. 25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2NA
难度: 中等查看答案及解析
-
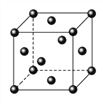
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
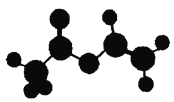
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物能发生水解反应,不能发生加聚反应
D. 该化合物的链状同分异构体中,能与NaHCO3反应放出CO2的只有3种
难度: 中等查看答案及解析
-
下列实验方案正确且能达到相应实验预期目的的是
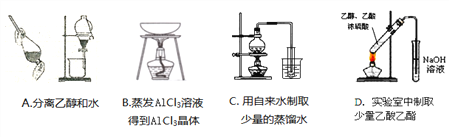
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下n为气体。m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是
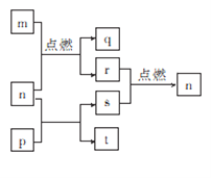
A. 原子半径:Z>Y
B. 化合物p中只存在离子键
C. 最简单气态氢化物的稳定性:W>X
D. 图示转化关系涉及的反应均为氧化还原反应
难度: 中等查看答案及解析
-
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)
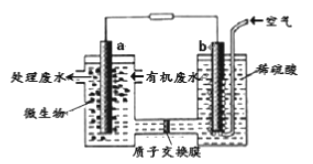
A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
难度: 中等查看答案及解析
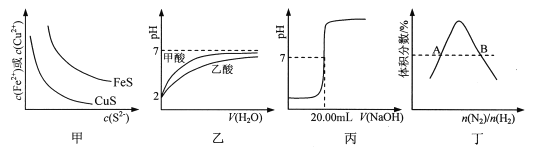
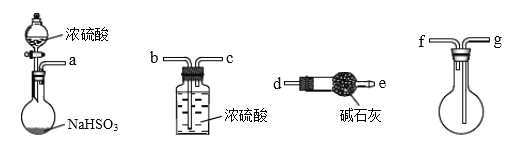
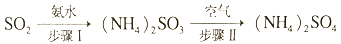
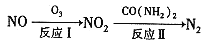
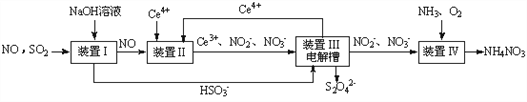

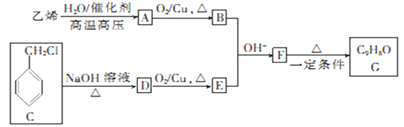

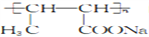 的合成路线:________________。
的合成路线:________________。