-
下列反应的离子方程式书写正确的是( )
A.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合
4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
B.硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
下列表述不正确的是
A. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
B. 硅是制造太阳能电池的常用材料
C. 四氧化三铁俗称铁红,可用作油漆、红色涂料
D. 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法正确的是( )
A. 相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B. 56gFe与足量盐酸反应转移电子数为3NA
C. 任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D. 46gNO2和N2O4的混合物含有的原子数为3NA
难度: 困难查看答案及解析
-
下列变化必须加入氧化剂才能发生的是
A. Cu2+→Cu B. Cl-→Cl2 C. H2SO4→SO2 D. CO2→CO32-
难度: 简单查看答案及解析
-
当光束通过下列物质:①尘埃的空气 ②氢氧化钠溶液 ③蒸馏水 ④淀粉溶液,能观察到有丁达尔现象的是
A. ①② B. ②③ C. ①④ D. ②④
难度: 中等查看答案及解析
-
下列关于胶体的叙述中,不正确的是
A.可用丁达尔效应区分溶液和胶体
B.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
C.Fe(OH)3 胶体的电泳实验说明了胶体粒子带有电荷
D.江河入海口三角洲的形成,通常与胶体的性质有关
难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+ 、Mg2+ 、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中顺序正确的是①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤ 加过量BaCl2溶液( )
A. ①④②⑤③ B. ④①②⑤③ C. ②⑤④①③ D. ②④①③⑤
难度: 中等查看答案及解析
-
将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
难度: 中等查看答案及解析
-
Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项
A
B
C
D
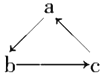
a
Na
Al
Fe
Cu
b
NaOH
Al2O3
FeCl3
CuSO4
c
NaCl
Al(OH)3
FeCl2
CuCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列氯化物中,既能由单质直接化合制得,又可由金属和盐酸反应制得的是( )
A. CuCl2 B. FeCl2 C. FeCl3 D. AlCl3
难度: 简单查看答案及解析
-
下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
①Al ②Al2O3③Ca(OH)2④Al(OH)3⑤Na2CO3⑥NaHCO3
A. ①②③⑤ B. ①②④⑥ C. ①②⑤⑥ D. ②③④⑥
难度: 中等查看答案及解析
-
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为
A. 5.6 g B. 11.2g C. 22.4g D. 33.6g
难度: 中等查看答案及解析
-
下列溶液中Cl--浓度由大到小的顺序是( )
①200 mL 2 mol/L MgCl2溶液 ②1000 mL 2.5mol/L NaCl溶液 ③300 mL 5 mol/L KClO3溶液 ④250 mL 1 mol/LFeCl3溶液
A. ②③①④ B. ④①②③ C. ①④②③ D. ③①④②
难度: 中等查看答案及解析
-
下列叙述不正确的是
A. 蒸馏实验时,应将温度计水银球置于蒸馏烧瓶支管口处
B. 蒸馏实验时,冷水从冷凝管下口入,上口出
C. 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液
D. 萃取实验时,应先后将上下两层液体从下口放出,并用不同烧杯盛放
难度: 中等查看答案及解析

