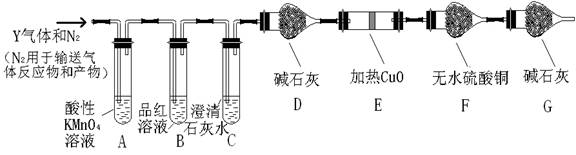
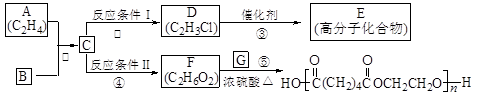-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是 ( )
A.发展氢能和太阳能 B.限制塑料制品的使用
C.大力建设火电厂 D.提高原子利用率,发展绿色化学
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法错误的是 ( )
A.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA
B.标准状况下,5.6L水中含有的分子数为0.25NA
C.20g D2O中含有的质子数目为10NA
D.标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA
难度: 困难查看答案及解析
-
下列离子方程式正确的是 ( )
A.向纯碱溶液中加入少量醋酸:CO32—+H+=HCO3—
B.向明矾溶液中滴加过量氨水:Al3++4OH—=AlO2—+2H2O
C.向稀硫酸中加入少量氢氧化钡溶液:H++SO42—+Ba2++OH—= BaSO4↓+ H2O
D.向烧碱溶液中通入少量二氧化碳:2OH—+CO2= CO32—+ H2O
难度: 困难查看答案及解析
-
在溶液中能大量共存的一组离子或分子是 ( )
A.NH4+、H+、NO3—、HCO3— B.Na+ 、CH3COO—、CO32—、OH—
C.Na+、K+、SO32—、Cl2 D.K+ 、Ag+、SO42—、NH3·H2O
难度: 困难查看答案及解析
-
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2g,则该样品的纯度(质量分数)是(相对原子质量:H—1 C—12 O—16 Na—23)
( )
A.
B.
C.
D.
难度: 困难查看答案及解析
-
化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是( )
A.定性检验SO42—,将BaCl2溶液用HNO3酸化
B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
C.配制FeCl3溶液时通常加少量HNO3酸化,减小其水解程度
D.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
难度: 困难查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是 ( )
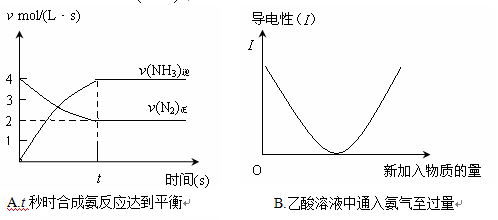
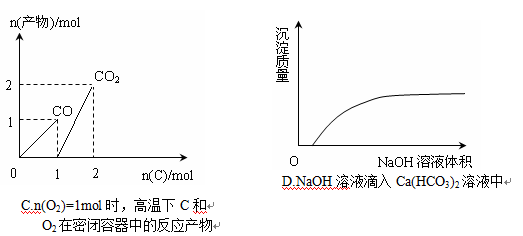
难度: 困难查看答案及解析