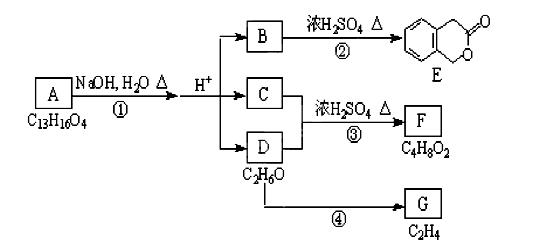
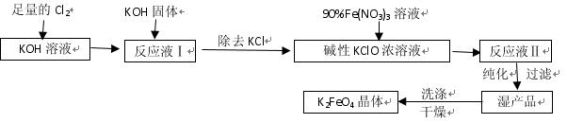
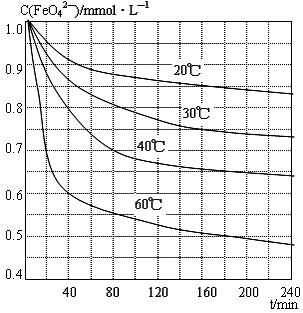
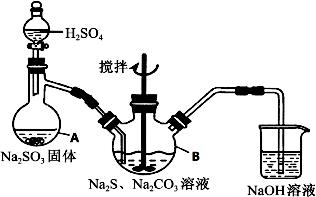
-
化学与人类生活密切相关,下列与化学有关的说法正确的是( )
A.温室效应是当今世界面临的环境问题,使温室效应增强的气体只有二氧化碳
B.侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
C.家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故
D.实验室里熔化氢氧化钠时,可选用石英坩埚和铁坩埚
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
B.1 mol Na2O2固体中含离子总数为4NA
C.1mol羟基与17 g NH3所含电子数之比为9:10
D.1mol Na2CO3晶体中含离子数小于1 NA
难度: 中等查看答案及解析
-
下列实验方案中,不能达到实验目的的是 ( )
选项
实验目的
实验方案
A
向醋酸钠溶液中滴入酚酞试液,加热后若红色加深
证明盐类的水解是吸热的
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
C
验证Br2的氧化性强于I2
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色
D
验证Fe(OH)3的溶解度小于Mg(OH)2
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
难度: 困难查看答案及解析
-
强热硫酸亚铁固体可反应:FeSO4
FexOy + SO2↑+O2↑+SO3↑(未配平),则下列有关判断不正确的是( )
A.若所得气体中SO2与O2的体积比为2:1,则FexOy为氧化亚铁
B.若所得FexOy为氧化铁,则气体中SO2与O2的体积比大于2:1
C.若所得FexOy为Fe3O4,则气体中SO2与O2的体积比为3:2
D.生成的混合气通入BaCl2溶液中,产生的沉淀为BaSO4
难度: 中等查看答案及解析
-
现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法正确的是
A.简单阳离子的氧化性:Y>X
B.气态氢化物的稳定性:Z>M
C.等浓度X2Z与Y2Z的溶液中,水的电离程度:X2Z>Y2Z
D.简单离子半径由大到小的顺序是:Z>M>Y
难度: 中等查看答案及解析
-
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A.K3C60中只有离子键 B.K3C60中不含共价键
C.该晶体在熔融状态下能导电 D.C60与12C互为同素异形体
难度: 中等查看答案及解析
-
3.04g铜镁合金完全溶解于含1.4molHNO3的浓HNO3中,得到NO2和N2O4混合气2240mL(标准状况下).向反应后的溶液中加入2mol•L﹣1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,下列说法不正确的是( )
①该合金中镁与铜的物质的量之比为1:2
②NO2和N2O4的混合气体中,N2O4的体积分数为80%
③得到5.08g沉淀时,加入NaOH溶液的体积是620mL
④该反应中共转移电子为1.2NA.
A.③ B.②③④ C.①③ D.①②③④
难度: 困难查看答案及解析