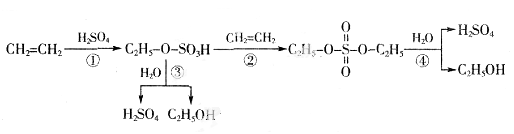
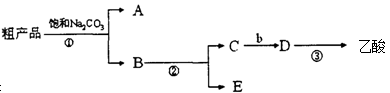
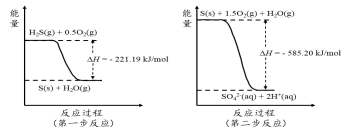
-
提高能源的利用率已成为国际能源研究的热点课题。下列相关措施使用不当的是( )
A.使燃料充分燃烧
B.加大能源开采力度
C.加强能源利用的科技投入
D.合理使用能源
难度: 简单查看答案及解析
-
下列金属使用电解法冶炼获得的是
A 、铝 B、锌 C、铜 D、金
难度: 简单查看答案及解析
-
下列说法中正确的是
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能够发生
C.反应物总能量大于生成物总能量的反应是吸热反应
D.反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热反应物
难度: 中等查看答案及解析
-
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
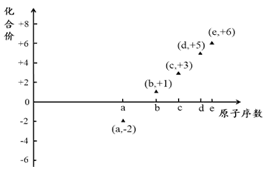
A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. 工业上常用电解法制备单质b和c
D. a和b形成的化合物不可能含共价键
难度: 简单查看答案及解析
-
在同温同压下,一定量的某有机物和过量的金属钠反应产生aL氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体bL,若a=b,则该有机物可能是( )
A、HOOC-COOH B、HOOC-CH2CH2OH
C、HOCH2-CH2OH D、CH3COOH
难度: 简单查看答案及解析
-
下列有机物中碳原子一定在一个平面内的是:( )
A、2-丁烯 B、丁烷 C、苯乙烯 D、环己烷
难度: 中等查看答案及解析
-
在一定温度下的恒容容器中,表明反应A(s)+2B(g)
C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强不随时间变化而变化
B.混合气体的密度不随时间变化而变化
C.气体C的物质的量不随时间变化而变化
D.单位时间内生成n mol C,同时消耗2n molB
难度: 中等查看答案及解析
-
密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B) = 3 v (A)、3 v (C) = 2 v (B)。则此反应可表示为
A.2A + 3B = 2C B.A + 3B = 2C C.3A + B = 2C D.A + B = C
难度: 中等查看答案及解析
-
在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物。如用CH3C≡CH合成CH2=C(CH3)COOCH3,欲使原子利用率达到最高,还需要的反应物是( )
A.H2和CO2 B.CO2和H2O C.CO和CH3OH D.CH3OH和H2
难度: 简单查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A. 元素W、Z 、Y具有相同电子层结构的离子,其半径依次增大
B. 元素X能与元素Y形成离子化合物X2Y2
C. 元素W、R的最高价氧化物对应的水化物都是强酸
D. 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
难度: 中等查看答案及解析
-
已知2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol;CO(g)+
O2(g)=CO2(g);ΔH=-282.9kJ/mol,某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.2∶3
难度: 中等查看答案及解析
-
下列物质能与溴水反应褪色的是 ( )
A.SO2 B.乙醇 C.苯 D.丁烯
难度: 中等查看答案及解析
-
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到右下图,则曲线c所对应的实验组别是
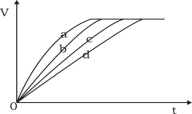
组别
c(HCl)(mol·L-1)
温度(℃)
状态
A
2.0
25
块状
B
2.5
30
块状
C
2.5
50
粉末状
D
2.5
50
块状
难度: 简单查看答案及解析
-
对于A2(g) + 3B2(g)==2C(g)的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.v(B2) =0.9mol/(L•s)
B.v(A2) =0.5mol/(L•s)
C.v(C) =0.62mol/(L•s)
D.v(B2) =90.0mol/(L•min)
难度: 简单查看答案及解析