-
设NA为阿伏加德罗常数,下列有关叙述正确的是
A. 5.8g正丁烷与异丁烷组成的混合气体中含有的C-H键数目为NA
B. 1mol的CO2和水蒸气的混合气体与过量Na2O2充分反应转移的电子数为2NA
C. 将0.2molNH3充入密闭容器中在一定条件下加热分解,生成N2的分子数为0.1NA
D. 相同温度下50mL0.1mol·L-1CH3COOH溶液和10mL0.5mol·L-1CH3COOH溶液中所含CH3COOH分子数相等
难度: 困难查看答案及解析
-
新装修房屋会释放有毒的甲醛(HCHO)气体,银-Ferrozine法检测甲醛的原理如下:
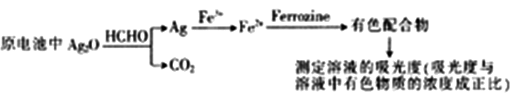
下列说法正确的是
A. 22.4LCO2中含共价键数目为4NA
B. 30gHCHO被氧化时转移电子数目为2 NA
C. 该电池总反应的化学方程式为2Ag2O+HCHO=4Ag+CO2↓+H2O
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比4:1
难度: 困难查看答案及解析
-
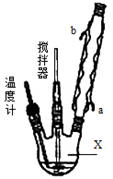
下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100 mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1 mol·L-1 盐酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是

A. 水样中一定不存在Fe3+、Cu2+,可能存在Ag+
B. 水样中一定存在CO32-、SO42-、Cl-
C. BC段曲线所表示的离子方程式为CO32-+2H+=H2O+CO2↑
D. 水样中一定存在K+,且c(K+)≥0.6mol·L-1
难度: 困难查看答案及解析
-
W、X、Y、Z分别为原子序数递增的短周期元素,X、Y的阳离子与Ne具有相同的电子层结构, 且其单质均可与冷水反应,生成W的单质;Z的单质为黄绿色气体。下列说法正确的是
A. W与X形成的简单二元化合物的电子式为
B. 短周期元素中Y的原子半径最大
C. 工业上通过电解Y的氧化物制取Y的单质
D. 最外层电子数等于其电子层数的金属与Z形成离子化合物
难度: 困难查看答案及解析
-
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)

下列推断不正确的是( )
A. 若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B. 若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
D. 若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
难度: 困难查看答案及解析
-
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示。下列关于亮菌甲素的说法中,正确的是

A. 亮菌甲素的分子式为C12H12O5
B. 1 mol亮菌甲素最多能和2mol NaOH反应
C. 1 mol亮菌甲素最多能和4 mol H2发生加成反应
D. 亮菌甲素在一定条件下可以与乙酸发生酯化反应
难度: 困难查看答案及解析
-
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法正确的是( )

A. a线代表的是PbCO3
B. T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=3×10-5
C. d点可以代表CaCO3的饱和溶液,且c(Ca2+)= c(CO32-)
D. T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
难度: 困难查看答案及解析