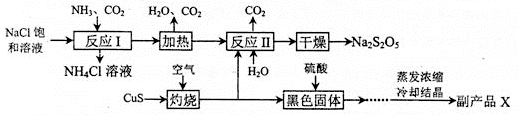
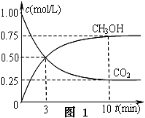
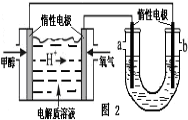
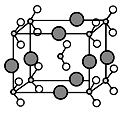
-
下列与化学有关的说法不正确的是( )
A.洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用
B.晶体的风化、煤的液化、石油的裂化都是化学变化
C.明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒
D.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1.7g羟基(—OH)中含有的电子数为NA
B.6.4g由S2、S4、S8组成的混 合物含硫原子数为0.2NA
C.标准状况下2.24L己烷分子中含有1.9NA对共用电子
D.标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
难度: 困难查看答案及解析
-
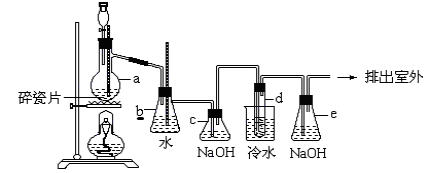
利用下列实验装置能完成相应实验的是( )

难度: 中等查看答案及解析
-
相对分子质量为100的有机物A能与钠反应,且完全燃烧只生成CO2和H2O。若A含一个六碳环,则环上一氯代物的数目为( )
A.4 B.5 C.3 D.2
难度: 困难查看答案及解析
-
下列离子或分子能够在指定的分散系中大量共存的是( )
A.空气中:SO2、NO、N2、NH3
B.0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42-
C.铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3-
D.与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3-
难度: 困难查看答案及解析
-
下列说法错误的是( )
A.室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10mol·L-1
B.向纯水中加入盐类物质,有可能促进水的电离,也有可能抑制水的电离
C.pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH4+):②<③<①
D.用0.1mol·L-1醋酸滴定0.1mol·L-1NaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+)
难度: 困难查看答案及解析
-
电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示,下列说法不正确的是( )
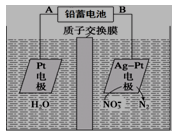
A.铅蓄电池的A极为正极,电极材料为PbO2
B.该电解池的阴极反应式为:2NO3- + 12H+ + 10e- = N2↑ + 6H2O
C.该电解池的总反应方程式为:2H2O + 4NO3-
2N2↑+ 5O2↑ + 4OH-
D.若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g
难度: 困难查看答案及解析