-
(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时, 能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
-
(18分)2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:
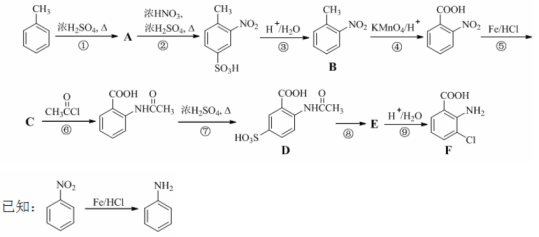
回答下列问题:
(1) 分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
分子中不同化学环境的氢原子共有_______种,共面原子数目最多为_______。
(2)B的名称为_________。写出符合下列条件B的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是______________。
(4)写出⑥的化学反应方程式:_________,该步反应的主要目的是____________。
(5)写出⑧的反应试剂和条件:_______________;F中含氧官能团的名称为__________。
(6)在方框中写出以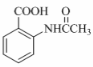 为主要原料,经最少步骤制备含肽键聚合物的流程。
为主要原料,经最少步骤制备含肽键聚合物的流程。
|  …… …… 目标化合物 目标化合物
|
-
(18分)用沉淀滴定法快速测定NaI等碘化物溶液中c(I−),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L−1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L−1 AgNO3溶液(过量),使I−完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L−1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有__________。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________________________。
(3)滴定应在pH<0.5的条件下进行,其原因是___________________________________。
(4)b和c两步操作是否可以颠倒________________,说明理由________________________。
(5)所消耗的NH4SCN标准溶液平均体积为_____mL,测得c(I-)=_________________mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为________________________。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_______________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____________________。
-
(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3 S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
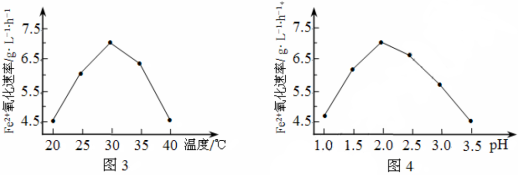
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液 Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l)  Ca(OH)2(s)
Ca(OH)2(s) Ca2+(aq)+2OH−(aq)
Ca2+(aq)+2OH−(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH−)=_________________mol·L−1。将SO2通入该氨水中,当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的c( )/c(
)/c( )=___________________。
)=___________________。
的废水并回收利用氨

”(ào)命名的第118号元素在周期表中位于第七周期0族
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。


 为主要原料,经最少步骤制备含肽键聚合物的流程。
为主要原料,经最少步骤制备含肽键聚合物的流程。