-
下列有关化学用语表示正确的是
A.中子数为20的氯原子:
B.HClO的电子式:
C.K2O的电子式:
D.熔融状态下硫酸氢钾的电离方程式:KHSO4=K++H++SO
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO
、S2-、SO
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反
D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
难度: 中等查看答案及解析
-
下列各组原子中,化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子
C.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
H2O2、SO2都能使酸性高锰酸钾褪色
前者表现出还原性后者表现出漂白性
B
纯银器表面在空气中渐渐变暗
发生了化学腐蚀
C
SiO2能与氢氟酸及碱反应
SiO2是两性氧化物
D
BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀
说明Ksp(BaSO4)大于Ksp(BaCO3)
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是
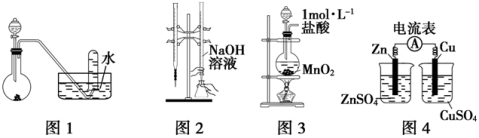
A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置检验电流的方向
难度: 中等查看答案及解析
-
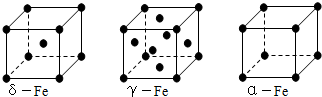
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱。由此判断下列说法正确的是
A.金属镁的熔点高于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的
C.金属镁的硬度小于金属钙
D.金属铝的硬度大于金属钠
难度: 中等查看答案及解析
-
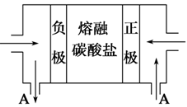
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol/LKOH溶液,下列说法中正确的是

A.放电时K+移向负极
B.放电时电池负极的电极反应为H2-2e-=2H+
C.放电时电池正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该电池充电时将碳电极与电源的正极相连
难度: 中等查看答案及解析
-
以下表述不符合元素周期律的是
A.酸性:H3PO4>HNO3>HClO4
B.热稳定性:HF>H2O>NH3
C.离子半径:F->Na+>Mg2+
D.还原性:HI>HBr>HCl
难度: 中等查看答案及解析
-
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是
A.Na+(g)+Cl-(g)===NaCl(s) ΔH B.Na(s)+
Cl2(g)===NaCl(s) ΔH1
C.Na(g)-e-===Na+(g) ΔH2 D.Cl(g)+e-===Cl-(g) ΔH3
难度: 中等查看答案及解析
-
处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是
A.元素的非金属性依次增强 B.元素的电负性依次减小
C.元素的第一电离能依次增大 D.最高价氧化物对应水化物的酸性依次减弱
难度: 中等查看答案及解析
-
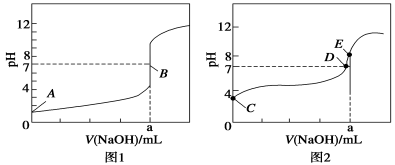
常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是
A.若a≤b,混合液的pH一定小于7
B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立
D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立
难度: 中等查看答案及解析
-
某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g)
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1
B.达平衡时压强变为原来的7/6
C.此温度下该反应的平衡常数为0.005
D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
难度: 中等查看答案及解析
-
T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
序号
NaOH溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
20.00
0.00
8
②
20.00
20.00
6
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
难度: 中等查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是

A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO
)一定等于3×10-3 mol·L-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
难度: 中等查看答案及解析