-
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上。如下图“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是:

难度: 简单查看答案及解析
-
下列有关化学用语和表述正确的是:
A.元素铯的两种核素137Cs比133Cs多4个质子
B.S2-的结构示意图:
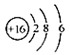
C.质子数为53,中子数为78的碘原子: 131 53I
D.氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%
=35.453中,75.77%表示35Cl的质量分数,35. 453表示氯元素的相对原子质量
难度: 简单查看答案及解析
-
欲配制100 mL 1.0 mol/L Na2SO4溶液,正确的方法是:
① 将14.2 g Na2SO4 溶于100 mL水中
② 将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL
③ 将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①② B.②③ C.①③ D.①②③
难度: 简单查看答案及解析
-
某非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素:
A.在自然界中只以化合态的形式存在 B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应 D.常温下与氯气反应
难度: 简单查看答案及解析
-
下列叙述正确的是:
A.同温同压下,相同体积的物质,其物质的量一定相等
B.任何条件下,等物质的量的氨气和一氧化碳所含的分子数一定相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若密度相等,则质量一定相等
难度: 简单查看答案及解析
-
等质量的两块钠,第一块在足量氧气中加热燃烧,第二块在足量氧气(常温)中充分反应,
则下列说法正确的是:
①两块钠失去电子一样多 ②第一块钠失去电子多 ③第二块钠失去电子多
④两块钠的产物质量一样大 ⑤第一块钠的产物质量大 ⑥第二块钠的产物质量大
A.①④ B. ①⑤ C.③⑥ D.②⑤
难度: 简单查看答案及解析
-
下列叙述正确的是:
A.液氯无酸性、氯水有酸性 B.海水提镁的主要步骤为:(下图)

C.硅酸钠固体俗称水玻璃 D.Na2O2能与水反应,可以做干燥剂
难度: 简单查看答案及解析
-
如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是:
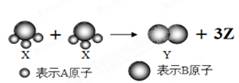
A.根据质量守恒定律可推知,1个Z分子中含有2个同种元素的原子
B.该反应属于分解反应
C.该反应属于氧化还原反应
D.X、Y、Z三种物质均属于非电解质
难度: 简单查看答案及解析
-
有人设想将不溶的碳酸盐材料通过特殊的加工方法使之变为纳米碳酸盐材料(即碳酸盐材
料粒子直径是纳米级),这将使建筑材料的性能发生巨大变化,下列关于纳米碳酸盐材料
的推测正确的是:
A.纳米碳酸盐材料是与胶体相似的分散系
B.纳米碳酸盐材料分散到水中会产生丁达尔效应
C.纳米碳酸盐材料的化学性质已与原来的碳酸盐材料完全不同
D.纳米碳酸盐材料的粒子不能透过滤纸
难度: 简单查看答案及解析
-
已知KMnO4与浓HCl在常温下反应就能产生Cl2。 若用右图所示装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元,其中错误的是:

A.只有①和②处 B.只有②处
C.只有②和③处 D.只有②、③、④处
难度: 简单查看答案及解析
-
工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是:
A.焦炭是铁矿石炼铁时的还原剂 B. 空气在与焦炭的反应中,为炼铁提供能量
C.石灰石是助矿石中杂质形成炉渣 D. 固体原料需粉碎,增大与气体的接触面
难度: 简单查看答案及解析
-
.常温下,下列各组离子在指定溶液中一定能大量共存的是:
A.在水溶液中: H+、I―、NO3―、SiO32-
B.饱和氯水中: Cl-、NO3-、Na+、SO32-
C.将足量CO2通入时:H+、NH4+、Al3+、SO42-
D.碱性溶液中:NO3-、I-、Na+、Al3+
难度: 简单查看答案及解析
-
下列化学反应所对应的离子方程式正确的是:
A.金属铝和过量的氢氧化钠溶液反应: 2OH-+Al=AlO2-+H2↑
B. AlCl3溶液中加过量的氨水:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
C. 明矾溶液中加入过量的Ba(OH)2:Al3++ SO42— + Ba2++ 4OH— = BaSO4↓+ AlO2— + H2O
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
难度: 简单查看答案及解析
-
下列叙述正确的是
A.过量的Fe粉与氯气和氯水反应所得氯化物相同
B.Na、Mg、Al分别与不足量的稀硫酸反应所得溶液均呈中性
C. 铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量FeCl3充分反应过滤除去
D.常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀
难度: 简单查看答案及解析
-
关于NaHCO3与Na2CO3说法正确的是:
① NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火
② NaHCO3粉末中混有Na2CO3,可配置成溶液通入过量的CO2,再低温结晶得到提纯
③ Ca(HCO3)2、Ba(HCO3)2、Mg(HCO3)2的溶解度都比其正盐的溶解度大,
因此,NaHCO3的溶解度也应该比Na2CO3的大
④Na2CO3固体中混有NaHCO3,高温灼烧即可
⑤区别NaHCO3与Na2CO3溶液,Ca(OH)2溶液和CaCl2溶液均可用
⑥在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,Na2CO3溶液中的红色褪去,
说明BaCl2溶液具有酸性。
A.①③ B. ③⑥ C.②④ D. ②⑤
难度: 简单查看答案及解析
-
某含Cr2O72- 的含铬废水用硫亚铁铵[(NH4)2 SO4·FeSO4·6H2O]处理,反应中铁元素和
铬元素(+3价)完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3 。不考虑处理过
程中的实际损耗,下列叙述错误的是:
A.消耗硫酸亚铁铵的物质量为n(2-x)mol B.处理废水中Cr2O72- 的物质的量为 mol
C.反应中发生转移的电子数为3nx mol D.在FeO·FeyCrxO3中3x=y
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是:
A.某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显紫色,则原溶液中有I-
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,
说明X溶液中一定含有Fe2+
C.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,
则说明原溶液中一定含SO42—
D.某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+
难度: 简单查看答案及解析
-
.甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、
HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种
物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+) >0.1mol/L;③ 向丙
溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是:
A.甲溶液含有Ba2+ B.乙溶液含有SO42- C.丙溶液含有Cl- D.丁溶液含有Mg2+
难度: 简单查看答案及解析
-
某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数
比为4:1,则在分解过程中该金属的化合价将:
A.无法确定 B.升高 C.不变 D.降低
难度: 简单查看答案及解析
-
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程
式为:2MnO4- +16H+ + 5Na2O2 ==== 2Mn2+ +5O2↑ + 8H2O + 10Na+ 下列判断正确的是:
A.高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂
B.反应的氧化产物只有氧气
C.当反应产生标准状况下2.24 L O2 时,反应转移的电子为0.1mol
D.向高锰酸钾溶液滴加浓盐酸可以得到酸性高锰酸钾溶液
难度: 简单查看答案及解析
-
(10分)镁的化合物具有广泛用途,请回答有关镁的下列问题:
(1) 单质镁在空气中燃烧的主要产物是白色的_________,还生成少量的_____(填化学式);
(2) 物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸
镁),反应后容器内固体物质的质量不可能为:________
A.3.2g B.4.0g C.4.2g D.4.6g
(3)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Mg2Cu是一种
储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)Mg2Cu与H2反应的化学方程式为________。
(4)点燃不纯的氢气可能会发生爆炸,为了防止意外,可连接一个安全装置。
下图的装置能起到此作用的是___________。

难度: 简单查看答案及解析


