-
人类对原子结构的认识经历了一个漫长的、不断深化的过程。早在公元前400多年,古希腊哲学家就把构成物质的最小单位叫原子,但直到丹麦科学家玻尔于1913年才建立起核外电子分层排布的原子结构模型。下列观点不属于玻尔原子结构模型的基本观点的是
A. 原子中的电子在具有确定半径的圆周轨道上绕原子核运动
B. 不同轨道上运动的电子具有不同的能量,且能量是量子化的。
C. 只有当电子从一个轨道跃迁到另一个轨道时,才会辐射或吸收能量。
D. 确定了原子结构的核式模型
难度: 简单查看答案及解析
-
下列有关物质结构的表述正确的是
A. 乙炔的结构式:H-C≡C-H
B. 氟原子的外围电子排布式:2s22p7
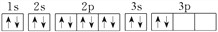
C. 镁原子核外电子的轨道表示式为:
D. 次氯酸的电子式:
难度: 简单查看答案及解析
-
下列电子排布式违反了泡利不相容原理的是
A. 硅原子的电子排布式:1s22s22p63s13p3
B. 碳原子的电子排布式:1s22s22p2
C. 钪原子的电子排布式1s22s22p63s23p64s3
D. 铬原子的电子排布式:1s22s22p63s23p63d44s2
难度: 简单查看答案及解析
-
图1和图2分别是1s电子的概率分布图和原子轨道图。下列有关认识正确的是

A. 图1中的每个小黑点表示1个电子
B. 图1中的小黑点表示某一时刻,电子在核外所处的位置
C. 图2表示1s电子只能在球体内出现
D. 图2表明1s轨道呈球形,有无数对称轴
难度: 简单查看答案及解析
-
下列有关认识正确的是
A. 原子的核外电子最易失去的电子能量最低
B. 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
C. p轨道电子能量一定高于s轨道电子能量
D. s能级电子绕核旋转,其轨道为一圆圈,而p能级电子是走
字形
难度: 简单查看答案及解析
-
第四周期的元素基态原子中,4s能级只有1个电子的元素共有
A. 1种 B. 2种 C. 3种 D. 4种
难度: 简单查看答案及解析
-
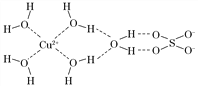
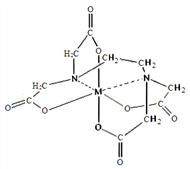
下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是
A. ①③ B. ①② C. ④⑤ D. ②④
难度: 简单查看答案及解析
-
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A. 在电流的作用下,氖原子与构成灯管的物质发生反应
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 电子由激发态向基态跃迁时以光的形式释放能量
难度: 中等查看答案及解析
-
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断错误的是
A. PH3沸点低于NH3沸点,因为P—H键键能低
B. PH3分子是极性分子
C. 一个PH3分子中,P原子核外有一个孤电子对
D. PH3分子稳定性低于NH3分子,因为N—H键键能高
难度: 简单查看答案及解析
-
下列叙述和判断正确的是
A. H3O+离子的空间构型是平面三角形
B. NH
的中心原子的杂化轨道类型是sp3杂化,离子呈三角锥形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D. C2H4分子中的碳原子以sp2杂化,其中C=C键是由两个碳原子的sp2-sp2轨道形成一个σ键和p-p轨道形成一个π键构成的
难度: 简单查看答案及解析
-
下列有关作用力的说法不正确的是
A. 酒精易溶于水是因为酒精分子与水分之间能形成氢键
B. 含极性键的分子不一定是极性分子
C. NH4Cl受热分解时只破坏离子键
D. HCl、HBr、HI的熔点沸点升高与范德华力大小有关
难度: 简单查看答案及解析
-
五种短周期元素的原子半径,最高正价及负化合价见下表,下列叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.130
0.089
0.118
0.102
0.074
化合价
+2
+2
+3
+6,-2
-2
A. L、M的单质与稀盐酸反应速率L < M
B. L、Q两原子的第一电离能大小为:L > Q
C. R、T两元素的氢化物分子间均能形成氢键
D. R、L两元素的简单离子的核外电子数相等
难度: 中等查看答案及解析
-
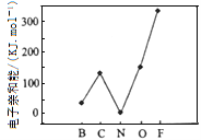
X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
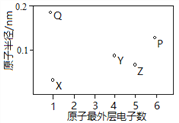
A. X与Q形成的化合物是离子化合物
B. X与Z的原子均含有1个未成对电子
C. Y与P形成的化合物YP2的分子空间构型是直线形
D. Q单质含有金属键,有自由移动的电子,因此可以导电
难度: 中等查看答案及解析
-
已知磷酸(
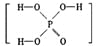 )分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
)分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是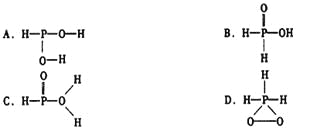
难度: 简单查看答案及解析
-
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子的核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。则下列说法不正确的是
A. W位于元素周期表第三周期第ⅤA族。
B. Z的简单离子与W的氢化物形成的配合离子中,W原子提供孤对电子
C. X、Y形成的化合物X2Y3在水中会发生双水解
D. Y的基态原子的核外电子排布式:1s22s22p63s23p4
难度: 中等查看答案及解析
-
电化学降解NO2— 的原理如图,下列有关说法正确的是
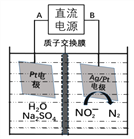
A. 直流电源的负极是A电极
B. 阳极反应式为:2NO2-+6e‑ +8H+ =N2↑+4H2O
C. 电解过程中H+将从右到左通过质子交换膜
D. 当电解过程中转移了6mol电子时,两极共产生2.5mol的气体
难度: 中等查看答案及解析
-
将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+ O2(g)
2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
实验编号
温度/℃
平衡常数/mol-1·L
起始量/mol
平衡量/mol
达到平衡所需时间/min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
A. T1、T2的关系:T1 > T2
B. x= 1.6,y=0.2 ,t<6
C. K1、K2的关系:K2>K1
D. 实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
难度: 中等查看答案及解析
-
常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液pH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是
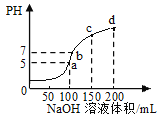
A. a、b、c、d四个点中,水的电离程度最大的是d
B. 常温下,NH3·H2O的电离平衡常数Kb=5×10-6
C. b点溶液中:c(Na+)+c(NH4+)=c(SO42—)
D. c点溶液中:3c(Na+)= 4[c(SO42—) +c(NH4+)+ c(NH3·H2O)]
难度: 中等查看答案及解析