-
a mol H2和2a molHe具有相同的
A.分子数 B.原子数 C.质子数 D.质量
难度: 简单查看答案及解析
-
0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度比为
A.15∶2 B.1∶1 C.3∶1 D.1∶3
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是
A.蒸馏水 B.稀H2SO4 C.CuSO4溶液 D.Fe(OH)3 胶体
难度: 简单查看答案及解析
-
下列物质的分类正确的是 ( )
混合物
非电解质
碱
酸式盐
A
漂白粉
Cl2
氨水
NaHCO3
B
福尔马林
苯
Cu2(OH)2CO3
明矾
C
胆矾
SO2
纯碱
NH4Cl
D
食醋
C2H5OH
苛性钾
NaHSO4
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列叙述正确的是
A.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
B.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
C.一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒
D.在标准状况下,2.24L苯中所含分子数约为NA
难度: 简单查看答案及解析
-
在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入b mol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c molNH3,则原溶液中的Al3+的浓度(mol/L)为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列能达到实验目的的是
①
②
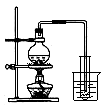 ③
③④
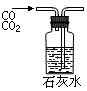
A.①吸收氨气制氨水 B.②制取少量蒸馏水
C.③转移溶液 D.④除去杂质气体CO2
难度: 简单查看答案及解析
-
配制一定物质的量浓度的某溶液,下列情况会使配制结果偏高的是
A. 将溶质用蒸馏水溶解后,未冷却即转移至容量瓶中并定容
B. 未洗涤溶解溶质用的烧杯及玻璃棒
C. 定容时仰视刻度线观察液面
D. 容量瓶中原来含有少量蒸馏水
难度: 简单查看答案及解析
-
在标准状况下,n L NH3溶于m mL水中,得到密度为
的氨水,则氨水的物质的量浓度是
A、
B、
C、
D、
难度: 简单查看答案及解析
-
一定量14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质的质量分数恰好增大一倍,体积变为62.5 mL。则浓缩后溶液的物质的量浓度为
A. 2.2 mol / L B. 4 mol / L C. 5 mol / L D. 6.25 mol / L
难度: 简单查看答案及解析
-
下列各溶液中,Na+浓度最大的是
A. 0.8L0.4mol/L的NaOH溶液 B. 0.2L0.15mol/L的Na3PO4溶液
C. 1L0.3mol/L的NaCl溶液 D. 4L0.5mol/L的NaCl溶液
难度: 简单查看答案及解析
-
相同物质的量浓度的
、
、
三种溶液,分别与体积相同、物质的量浓度相同的
溶液恰好完全反应,消耗的这三种溶液的体积比是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法中正确的是
A.1 mol·L-1的NaCl溶液是指此溶液中含有1 mol NaCl
B.从1L 0.5mol·L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol·L-1
C.0℃时,1 mol Cl2的体积约为22.4 L
D.1 mol·L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol·L-1
难度: 简单查看答案及解析
-
由Na2SO4和NaNO3组成的混合物88g溶于水配制成1L溶液,此溶液中Na+的浓度为1.2mol/L,则原混合物中NaNO3的质量为
A. 17g B. 34g C. 25.5g D. 51g
难度: 简单查看答案及解析
-
在体积为VmL、密度为dg·cm-3的溶液中,溶有式量为M的溶质mg,其物质的量浓度为cmol·L-1,质量分数为w%,则下列表示式中正确的是
A、c=
B、m=Vd
C、w%=
D、c=
难度: 简单查看答案及解析
-
将Cu片放入0.1mol·L-1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为
A 3∶2 B 3∶5 C 4∶3 D 3∶4
难度: 简单查看答案及解析

