-
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是
A、反应进行的方向 B、反应的快慢
C、反应进行的限度 D、反应物的多少
难度: 简单查看答案及解析
-
25℃、1.01×105Pa,下列哪个反应放出的热量表示乙炔的燃烧热(单位:kj·mol-1)
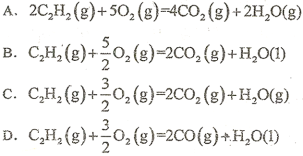
难度: 中等查看答案及解析
-
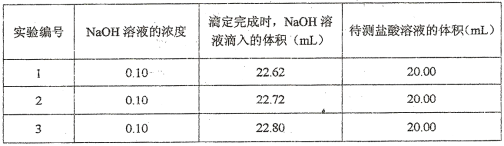
在一定条件下,有可逆反应
 。当单独改变下列条件后,有关叙述中错误的是
。当单独改变下列条件后,有关叙述中错误的是A、加入氩气,
都增大,且
增大倍数大于
增大倍数
B、加入催化剂,
都发生变化,且变化的倍数相同
C、增大压强时,
都增大,且
增大倍数大于
增大倍数
D、降低温度时,
都减小,且
减小倍数小于
减小倍数
难度: 困难查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A、实验室可以用排饱和食盐水的方法收集氯气
B、将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C、高压有利于工业上合成氨
D、打开汽水瓶时,瓶中立即泛起大量泡沫
难度: 中等查看答案及解析
-
密闭容器中的可逆反应
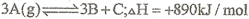 (A的式量为120)随着温度升高,容器中气体平均相对分子质量减小,则下列判断正确的是
(A的式量为120)随着温度升高,容器中气体平均相对分子质量减小,则下列判断正确的是A、若C为固体,则B一定是气体
B、B和C一定都是气体
C、若起始时往容器中投入18gA,则反应吸收的热量为44.5kJ
D、若起始时往容器中投入18gA,则反应放出的热量为44.5kJ
难度: 中等查看答案及解析
-
如下图,关闭活塞K,向A中充入1mo1X、1mo1Y,向B中充入2 mo1X、2mo1Y,此时A、B的体积都等于aL。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:
 。
。A、保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。

下列说法错误的是
A、反应速率:v(B)>v(A) B、A容器中X的转化率为80%
C、平衡时的压强:p(B)>2p(A) D、平衡时Y的体积分数:A>B
难度: 困难查看答案及解析
-
反应
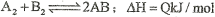 ,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是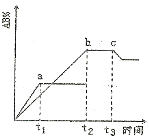
A、A2、B2及AB均为气体,Q>0
B、AB为气体,A2、B2中有一种为非气体,Q>0
C、AB为气体,A2、B2中有一种为非气体,Q<0
D、AB为固体,A2、B2中有一种为非气体,Q>0
难度: 中等查看答案及解析
-
对于平衡体系mA(g)+nB(g)
pC(g)+qD(g);△H<0,下列结论中不正确的是
A、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度变为原来的2.1倍,则m+n<p+q
B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到平衡时,气体的总物质的量等于2a
D、若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来1/2要小
难度: 困难查看答案及解析
-
下列溶液一定呈中性的是
A、pH=7的溶液
B、c(H+)=c(OH-)的溶液
C、由强酸、强碱等物质的量反应得到的溶液
D、非电解质溶于水得到的溶液
难度: 简单查看答案及解析
-
下列叙述正确的是
A、95℃纯水的pH<7,说明加热可导致水呈酸性
B、pH=3的醋酸溶液,稀释至10倍后pH=4
C、0.2mo1/L的盐酸,与等体积水混合后pH=1
D、pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
难度: 中等查看答案及解析
-
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是
A、弱碱的浓度大于强酸的浓度
B、反应后的溶液呈酸性
C、原氨水中有1%的含氮微粒为
D、反应后的溶液中
 三种微粒的平衡浓度之和为
三种微粒的平衡浓度之和为
难度: 困难查看答案及解析
-
下列各组数据中比值不为1:1的是
A、100℃时,pH=6的纯水中,c(OH-)与c(H+)之比
B、常温下,pH=1的HF溶液与
的盐酸中
之比
C、常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比
D、常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比
难度: 困难查看答案及解析
-
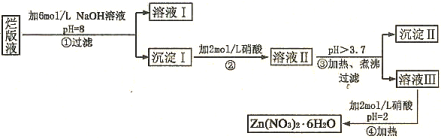
下列实验能实现的是
①加热蒸干硫酸铝溶液并灼烧以制得硫酸铝固体;
②加热蒸干氯化铝溶液并灼烧以制得氧化铝固体;
③用湿润的pH试纸来测定碳酸钠溶液的pH;
④用pH相同的两种酸与锌反应,由开始时的反应速率来比较这两种酸的相对强弱;
⑤盛放待测液的锥形瓶先用待测液润洗,而后再注入待测液进行滴定以测待测液的浓度。
A、①② B、①⑤ C、②⑤ D、①②⑤
难度: 中等查看答案及解析
-
某浓度的氨水中存在下列平衡:
 ,如想增大
,如想增大的浓度,而不增大
的浓度,下列措施不正确的是
A、适当升高温度 B、加入NH4Cl固体
C、加少量MgC12 D、加入少量盐酸
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A、

B、

C、

D、

难度: 困难查看答案及解析
-
室温下,0.1mol·L-1的NaHB溶液中c(H+)>c(OH-)。则下列关系中一定正确的是

难度: 困难查看答案及解析
-
一定能在下列溶液中大量共存的离子组是
A、水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+、Na+、C1-、HCO3-
B、含有大量Fe3+的溶液:SCN-、I-、K+、Br-
C、能使pH试纸变蓝色的溶液:Na+、S2-、CO32-、AlO2-
D、澄清透明的无色溶液:CIO-、MnO4-、A13+、SO42-
难度: 中等查看答案及解析
-
有关常温下pH均为3的醋酸和硫酸的说法正确的是
A、两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1
B、分别加水稀释100倍后,两种溶液的pH仍相同
C、醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D、分别加入足量锌片,两种溶液生成H2的体积相同
难度: 中等查看答案及解析
-
已知

 ;
;


难度: 困难查看答案及解析
-
下列比较中,正确的是
A、常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
B、0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+) >c(OH-)>c(H+)
C、物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
D、同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③
难度: 困难查看答案及解析