-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )

A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
难度: 简单查看答案及解析
-
关于pH相同的醋酸和盐酸溶液,下列叙述中正确的是( )
A.取等体积的两种酸溶液分别稀释至原溶液的m倍,溶液的pH仍然相同
B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸
C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多
D.两种酸溶液中c(CH3COOH)=c(HCl)
难度: 简单查看答案及解析
-
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图所示。该电池工作时,下列说法正确的是( )
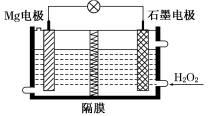
A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.
溶液中Cl-向正极移动
难度: 简单查看答案及解析
-
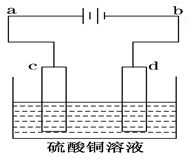
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考图示从表中选出正确选项( )
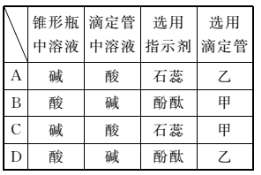

难度: 简单查看答案及解析
-
用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,就能使溶液浓度恢复到电解前浓度的是( )
A.NaCl B.Na2CO3 C.CuSO4 D.K2S
难度: 简单查看答案及解析
-
一定条件下,固定容积的密闭容器中发生反应H2(g)+I2(g)
2HI(g)Δ
H<0,达到平衡时,下列说法正确的是( )
A.向容器中加入惰性气体,平衡向右移动
B.加入催化剂,HI的产率增大
C.降低温度,H2的转化率减小
D.无论平衡正向或是逆向移动时,混合气体的平均分子量不变
难度: 简单查看答案及解析
-
哥本哈根气候大会,是被称作“人类拯救地球的最后一次机会”的联合国气候变化大会。下列措施有利于节能减排、改善环境质量的是( )
①回收再利用废弃的塑料、金属、纸制品及玻璃等资源 ②发展低碳经济、循环经济,开发推广太阳能、水能、风能等能源,减少煤、石油等化石燃料的使用 ③使用填埋法处理未经分类的生活垃圾 ④推广使用燃煤脱硫技术,防治SO2污染 ⑤研制开发新型燃料电池汽车,减少机动车尾气污染
A.①②④⑤ B.①②⑤ C.①②③④ D.③④⑤
难度: 简单查看答案及解析