-
下列说法不正确的是
A.CO2、甲烷都属于温室气体
B.用甘蔗生产的乙醇燃料属于可再生能源,利用乙醇燃料不会产生温室气体
C.太阳能、风能和生物能源属于新能源
D.太阳能电池可将太阳能直接转化为电能
难度: 简单查看答案及解析
-
下列反应中,其放出热量的是
①NaOH溶液中加入盐酸 ②由乙醇制C2H4 ③铝热反应 ④由氯酸钾制O2
A.①② B.②③ C.①③ D.①④
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g) === 2HF(g) ΔH =-270 kJ·mol-1,下列说法正确的是
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
难度: 简单查看答案及解析
-
25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5518 kJ·mol-1。下列热化学方程式书写正确的是
A.2H+(aq)+SO42— (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+1/2H2SO4(aq)===1/2 K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g) ΔH=-5518 kJ·mol-1
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5518 kJ·mol-1
难度: 简单查看答案及解析
-
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3
下列说法正确的是
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)===S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s) ΔH3>0,单斜硫比正交硫稳定
难度: 简单查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 简单查看答案及解析
-
已知 (1)
===H2O(g) △H1=a kJ·
(2)
===2H2O(g) △H2=b kJ·
(3)
===H2O(l) △H3=c kJ·
(4)
===2H2O(l) △H4=d kJ·
下列关系式中正确的是
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 简单查看答案及解析
-
已知:①2C(s)+O2(g)===2CO(g) ΔH1 ②2CO(g)+O2(g)===2CO2(g) ΔH2
下列说法中正确的是
A.碳的燃烧热ΔH为0.5ΔH1 kJ·mol-1 B.②能表示CO燃烧热的热化学方程式
C.碳的燃烧热ΔH=0.5(ΔH1+ΔH2) D.碳的燃烧热小于CO的燃烧热
难度: 简单查看答案及解析
-
已知下列热化学方程式:①Zn(s)+O2(g)===ZnO(s) ΔH1 ;②Hg(l)+O2(g)===HgO(s) ΔH2
则Zn(s)+HgO(s)===Hg(l)+ZnO(s) ΔH3,ΔH3的值为
A.2ΔH2-ΔH1 B.2ΔH1-ΔH2 C.ΔH1-ΔH2 D.ΔH2-ΔH1
难度: 简单查看答案及解析
-
一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列叙述正确的是
A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(l) ΔH=-867 kJ·mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol
难度: 简单查看答案及解析
-
在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
难度: 简单查看答案及解析
-
对反应4A+5B===4C+6D,以下化学反应速率的表示中,所表示反应速率最快的是
A. v (A)=0.40mol•L-1•s-1 B. v (B)=0.48mol•L-1•s-1
C. v (C)=0.36mol•L-1•s-1 D. v (D)=0.55mol•L-1•s-1
难度: 简单查看答案及解析
-
在密闭容器中,进行可逆反应,A与B反应生成C,其反应速率分别为v 1、v 2、v 3(单位:mol·L-1·s-1 ),且v 1、v 2、v 3之间有如下关系:3 v 1=v 2,2 v 1=v 3,2 v 2=3 v 3,则此反应表示为
A.A+B
C B.2A+2B
3C
C.3A+B
2C D.A+3B
2C
难度: 简单查看答案及解析
-
从下列实验事实所引出的相应结论正确的是
选项
实验事实
结论
A
其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短
当其他条件不变时,增大反应物浓度化学反应速率加快
B
在化学反应前后,催化剂的质量和化学性质都没有发生改变
催化剂一定不参与化学反应
C
物质的量浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应
反应开始速率相同
D
在容积可变的密闭容器中发生反应
H2(g)+I2(g)
2HI(g),把容积缩小一倍
正反应速率加快,逆反应速率不变
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是
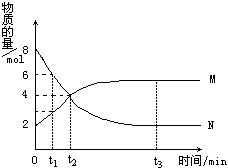
A. 反应的化学方程式为:2M
N B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率 D. t1时,N的浓度是M浓度的2倍
难度: 简单查看答案及解析
-
反应4A(g)+3B(g)
2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
①用A表示的反应速率是0.4 mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①② B.③ C.① D. ②④
难度: 简单查看答案及解析
-
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量 ③通入CO2 ④恒容下充入N2 ⑤恒压下充入N2能够使反应速率增大的措施是
A.①④ B.②③⑤ C.①③ D.①②④
难度: 简单查看答案及解析
-
在一定条件下,反应:2NO+O2
2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是
①混合气体的总分子数不再变化 ②混合气体的颜色不再变化 ③容器的总压强不再变化 ④混合气体的总质量不再变化 ⑤混合气体的密度不再变化 ⑥单位时间内生成n mol的NO,同时消耗n mol的NO2 ⑦反应的温度不再发生变化(绝热条件)
A. ①②③⑦ B. ④⑤⑥ C. ①②④ D. ③⑦⑤⑥
难度: 简单查看答案及解析
-
COCl2(g)
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
难度: 简单查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g) ΔH<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
难度: 简单查看答案及解析



