-
下列条件一定能使反应速率增大的是( )
① 增加反应物的物质的量 ② 升高温度 ③ 缩小反应容器的体积
④ 不断分离出生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.②③ D.②
难度: 中等查看答案及解析
-
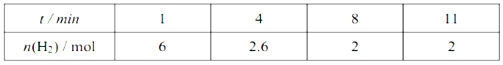
在一密闭恒容容器中发生如下反应:aX(g)+bY(g)
cZ(g) △H>0,达平衡后,当其他条件不变时,下列说法正确的是
A. 升高温度,正反应速率增大,逆反应速率减小,平衡常数增大
B. 若通入稀有气体平衡不移动,则a+b=c
C. 若加入催化剂,反应速率改变,但平衡不移动
D. 若增加X的量,平衡正向移动,X的转化率增大
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2 CO(g)+O2(g)反应的△H=2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
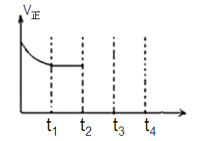
在密闭容器中,反应2X(g)+Y2(g)
2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
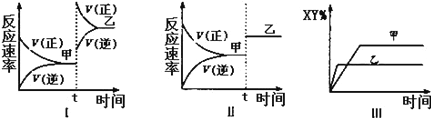
A. 图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B. 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C. 图Ⅱ中,t时间是增大了压强
D. 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
难度: 中等查看答案及解析
-
对于反应A(g)+3B(g)═ 4C(g)+2D(g),在相同时间内,用不同物质表示的平均反应速率如下,则反应速率最快的是
A. v(A)=0.4 mol/(L•s) B. v(B)=48 mol/(L•min)
C. v(C)=72 mol/(L•min) D. v(D)=0.7 mol/(L•s)
难度: 中等查看答案及解析
-
在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)
3Z(g) ΔH,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
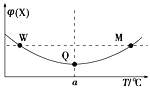
A. M点时,Y的转化率最大
B. W、M两点Y的正反应速率相等
C. 升高温度,平衡常数减小
D. 平衡后充入Z达到新平衡时Z的体积分数增大
难度: 困难查看答案及解析
-
将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A.该反应的△H>0
B.NH3的体积分数不变时,该反应一定达到平衡状态
C.A点对应状态的平衡常数K(A)=10-2.294
D.30℃时,B点对应状态的υ(正))<υ(逆)
难度: 中等查看答案及解析