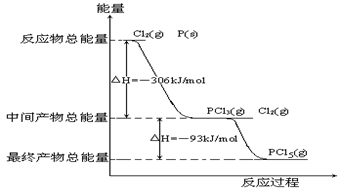
-
21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是 ( )
A.电力 B.核能 C.太阳能 D.氢能
难度: 简单查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧 C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
下列说法正确的是
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
难度: 简单查看答案及解析
-
已知,
则反应
的
为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
A. 0.2Q B. 0.1Q C. 5Q D. 10Q
难度: 简单查看答案及解析
-
下列热化学方程式中△H的值能表示可燃物的燃烧热的是( )
A、H2(g)+Cl2(g)= 2HCl(g) △H=-184.6kJ/mol
B、CH4(g)+2O2(g)= CO2(g)+2H2O(g)△H=-802.3kJ/mol
C、2H2(g)+O2(g)= 2H2O(l); △H=-571.6kJ/mol
D、CO(g)+1/2O2(g)= CO2(g); △H=-283kJ/mol
难度: 简单查看答案及解析
-
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )
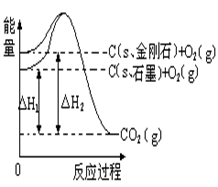
A. C(s、石墨)== C(s、金刚石) △H= +1.9 kJ•mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 简单查看答案及解析
-
在36 g 碳不完全燃烧所得气体中,CO占
体积,CO2占
体积,且
C(s) + O2(g) = CO(g) △H = -110.5 kJ/mol
CO(g) + O2(g) = CO2(g) △H = -283 kJ/mol
与这些碳完全燃烧相比,损失的热量是
A.172.5 kJ B. 1149 kJ C.283kJ D. 517.5 kJ
难度: 简单查看答案及解析
-
在2A+B == 3C+4D反应中,下面表示的反应速率最快的是( )
A. VA=3.0mol·L-1·min-1 B. VB=0.28mol·L-1·S-1
C. VC=4.8mol·L-1·min-1 D. VD=1.0mol·L-1·S-1
难度: 简单查看答案及解析
-
在一定温度下,下列叙述不是可逆反应
达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)2v正(B)=3v逆(C);(5)混合气体的总压强不再变化;(6)混合气体的物质的量不再变化;(7)混合气体的平均相对分子质量保持不变时;(8)A、B、C的分子数目比为1:3:2。
A. (2)(8) B. (7)(4) C. (1)(3) D. (5)(6)
难度: 简单查看答案及解析
-
已知热化学方程式:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8KJ/mol 当lg液态水变为水蒸汽时,其热量变化是
A.吸热88kJ B.吸热2.44J C.放热44kJ D.吸热44kJ
难度: 简单查看答案及解析
-
下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 简单查看答案及解析
-
在2升的密闭容器中,发生以下反应:2A(气)+B(气)
2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
难度: 简单查看答案及解析
-
在可逆反应中,改变下列条件一定能加快反应速率的是
A.增大反应物的量 B.升高温度 C.增大压强 D.使用催化剂
难度: 简单查看答案及解析
-
已知(1)H2O(g) ==H2O(l) ΔH1=—Q1 kJ·mol-1(2)CH3OH(g) ==CH3OH(l) △H2=—Q2 kJ·mol-1 (3)2CH3OH(g) +3O2(g) ==2CO2(g)+4H2O(g) △H3=—Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ) ( )
A. Q1+Q2+Q3 B. 0.5 Q3-Q2+2Q1 C. 0.5 Q3+ Q2-2Q1 D. 0.5(Q1+Q2+Q3)
难度: 简单查看答案及解析