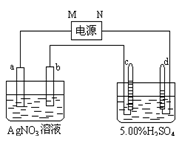
-
将纯水加热至较高温度,下列叙述正确的是
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离子积变大、pH变小、呈中性
难度: 中等查看答案及解析
-
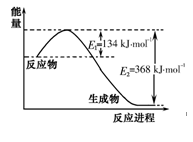
下列关于热化学反应的描述中正确的是
A、HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C、需要加热才能发生的反应一定是吸热反应
D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
难度: 简单查看答案及解析
-
下列说法正确的是
A、活化分子相碰撞即可发生化学反应
B、升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C、某一反应的活化分子百分率是个定值
D、浓度增大使得反应物分子中活化分子百分率增大
难度: 简单查看答案及解析
-
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是
A. c(M+)>c( OH―)> c(A-)>c(H+) B. c(M+)> c(A-)>c(H+)>c( OH―)
C. c(M+)> c(A-)>c( OH―)>c(H+) D. c(M+)>c(H+) =c( OH―)+ c(A-)
难度: 简单查看答案及解析
-
下列变化过程中,ΔH<0、ΔS>0的是
A..CaCO3(S)分解为CaO(S)和CO2(g) B.2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g)
C.NH4NO3(s)===NH(aq)+NO(aq) D.Cl2===2Cl
难度: 简单查看答案及解析
-
下列溶液中各微粒的浓度关系正确的是
A.1.0mol/Lna2CO3溶液:c(OH一)=c(H+)+c(H2CO3)+c(HCO3-)
B.pH=6的纯水:c(H+)>c(OH一)
C.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c(NH4)2SO4>c(NH4HSO4)>c(NH4C1)
D.向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液: c(Na+)>c(CH3COO一)>c(H+)>c(OH一)
难度: 简单查看答案及解析
-
在容积不变的密闭容器中存在如下反应:
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
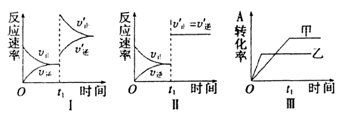
A.图I表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图II表示的一定是^时刻加入催化剂后对反应速率的影响
C. 图III表示的是温度对化学平衡的影响,且乙的温度较高
D. 图III表示的是催化剂对平衡的影响,且甲的催化效率比乙高
难度: 简单查看答案及解析