-
生活中的下列现象与原子核外电子发生跃迁有关的是( )
A.钢铁长期使用后生锈 B.节日里燃放的焰火
C.金属导线可以导电 D.卫生球久置后消失
难度: 简单查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2 B.NaCl和HCl C.CCl4和KCl D.NH3和H2O
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.元素电负性越大,元素第一电离能越大
B.键能越大,键长越长,共价化合物越稳定
C.副族元素中没有非金属元素
D.离子化合物的熔点一定比共价化合物的高
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数,下列说法中正确的是( )
A.0.1mol过氧化钠固体中含阴离子个数为0.2NA
B.1mol金刚石中含C-C的数目为4NA
C.标准状况下,22.4L乙炔中含π键数为2NA
D.1molNaHSO4晶体中阳离子数为2NA
难度: 简单查看答案及解析
-
碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体:①金刚石 ②碳化硅 ③二氧化硅中,它们的熔点由高到低的顺序是
A.①②③ B.①③② C.③①② D.②①③
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.N2分子中有一个σ键,2个π键
D.气体单质中,一定有σ键,可能有π键
难度: 简单查看答案及解析
-
已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2—的空间构型为( )
A.直线型 B.平面正方形 C.正四面体型 D.正八面体型
难度: 简单查看答案及解析
-
有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯。其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
A.①④⑥⑦ B.④⑥⑦⑧ C.①②③⑤ D.②③⑤⑧
难度: 简单查看答案及解析
-
有A、B两种烃,所含碳元素的质量分数相同,关于A和B叙述中正确的是( )
A.二者不可能是同系物 B.二者一定是同分异构体
C.二者最简式相同 D.各1mol的A和B分别燃烧生成CO2的质量一定相等
难度: 简单查看答案及解析
-
在卤代烃RCH2CH2X中化学键如下所示,则下列说法正确的是( )

A.发生水解反应时,被破坏的键是①和③
B.发生消去反应时,被破坏的键是①和③
C.发生水解反应时,被破坏的键是①和②
D.发生消去反应时,被破坏的键是①和②
难度: 简单查看答案及解析
-
已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是( )
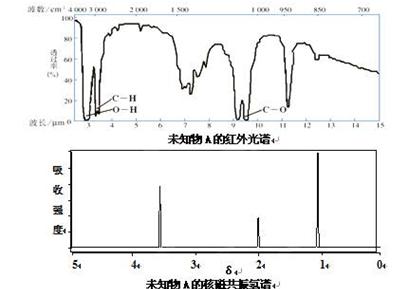
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3
C.仅由其核磁共振氢谱可知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3CH2OH
难度: 简单查看答案及解析
-
常温常压下,10mL某气态烃与50mL O2混合点燃并完全燃烧后恢复到原来状况,剩余气体为35mL,则此烃的化学式为( )
A.C3H4 B.C2H6 C.C2H4 D.C6H6
难度: 简单查看答案及解析
-
分子式C3H6Cl2的氯代烷分子中的一个氢原子被氯原子取代后,可得到两种同分异构体,则C3H6Cl2的名称是( )
A.1,3-二氯丙烷 B.1,1-二氯丙烷
C.1,2-二氯丙烷 D.2,2-二氯丙烷
难度: 简单查看答案及解析
-
已知A、B、C均为短周期的元素,A、B同周期、A、C的最低价离子分别为A2—和C—,B2+和C—具有相同的电子层结构,下列说法正确的是( )
A.C元素的最高正价为+7价 B.离子半径:A2—>C—>B2+
C.对应气态氢化物的稳定性:A>C D.还原性:A2—<C—
难度: 简单查看答案及解析
-
下列分子中的所有原子都满足最外层8电子结构的是 ( )
A.六氟化氙(XeF6) B.次氯酸(HClO)
C.氯化硫(SCl2) D.三氟化硼(BF3)
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.CS2为V形的极性分子
B.电子云示意图中的每个小黑点都表示一个电子
C.非极性键也可以存在于化合物中
D.甲烷、氨和水都是由极性键结合而成的极性分子
难度: 简单查看答案及解析
-
下列有关物质结构和性质的说法中,正确的是( )
A.元素非金属性Cl>S的实验依据是酸性HCl>H2S
B.二氧化碳分子中存在共价键和分子间作用力
C.SO32—的中心原子为sp2杂化
D.ClO3—的空间构型为三角锥形
难度: 简单查看答案及解析
-
有关晶体结构的叙述中,错误的是 ( )

A.金刚石的正四面体网状结构中最小的环上有6个碳原子
B.如图在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
C.在氯化钠晶体中,每个氯离子周围都紧邻8个钠离子
D.分子晶体干冰也是面心立方晶胞,每个晶胞平均含有4个CO2分子
难度: 简单查看答案及解析
-
已知信息:[Cu(NH3)4]SO4的电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。 具有6个配体的Co3+的配合物CoClm·nNH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m、n的值分别是( )
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=3,n=3
难度: 简单查看答案及解析
-
卤代烃A(C2H5X)是一种无色液体,为探究A的性质,设计如下实验方案。
方案一:往A中加入硝酸银溶液,充分振荡,静置。
方案二:往A中加过量NaOH水溶液,充分振荡,静置,待液体分层后,取“水层”溶液少许,滴加硝酸银溶液。
方案三:往A中加入过量NaOH乙醇溶液,共热,充分反应后,取溶液少许,依次加入试剂B、硝酸银溶液,得白色沉淀。
根据以上信息回答问题。
(1)C2H5X中的X是________。 (写化学式)
(2)方案一中可观察到的现象是________。
(3)有人认为方案二达不到检验X-的实验目的,理由是________。
(4)方案三中,试剂B是________。写出方案三中可能发生反应的化学方程式________
难度: 简单查看答案及解析
-
X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高。N原子外围未成对电子数是同周期中最多的。W元素的电离能数据见下表(kJ·mol-1):
I1
I2
I3
I4
…
496
4562
6912
9540
…
请回答:
(1)W2Y2含有的电子式为 ________。灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因:________。
(2)N元素基态原子的外围电子排布式是:________。
(3)X3-的空间构型是________,中心原子的杂化方式是________。
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键 ________ ________。
难度: 中等查看答案及解析
-
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z基态原子的核外电子排布式是________;
(2)X、Y可组成一化合物,其原子个数之比为5:1。其化学式中含有的化学键有________。
(3)YX3分子的空间构型是________,中心原子的杂化方式是________;Y的氢化物的沸点比W的氢化物的沸点________(填“高”或“低”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为________。
难度: 中等查看答案及解析
-
已知:A、B、C、D、E为周期表中前四周期的五种元素,它们的原子序数依次增大。A的基态原子有3个不同的能级,各能级中电子数相等;B的基态原子2p能级上的未成对电子数与A原子的相同;B2- 离子与 C2+离子具有相同的稳定电子层结构;D有“生物金属”之称,D4+离子和氩原子的核外电子排布相同;E的基态原子的价电子排布式为3d84s2。
请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是________________(填元素符号)。
(2)在D的单质晶体中,原子的堆积方式与Mg同,则其堆积方式是 ________,D原子的配位数是 。

(3)氢气是理想的清洁能源,E元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如上图所示,晶胞中心有一个E原子,其他E原子都在晶胞面上,则该晶体的化学式为________。已知该晶体的密度为d g·cm-3,其晶胞的边长为a cm,则该物质的摩尔质量是________。(阿伏伽德罗常数用NA表示)
难度: 简单查看答案及解析