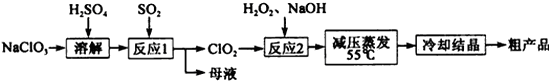
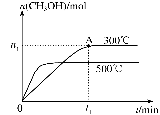
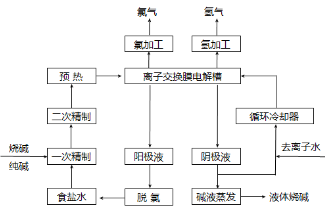
-
下列有关叙述正确的是
A.在结冰路面上撒盐,是利用盐与水发生反应放出大量热,促使冰雪融化
B.蛋白质、棉花、核酸、PVC、淀粉、豆油都是由高分子组成的物质
C.利用可降解的生物质材料“玉米塑料”(主要成分为聚乳酸)替代一次性饭盒,可减少白色污染的产生
D.绿色化学的核心是利用化学原理对环境污染进行治理
难度: 中等查看答案及解析
-
分子式为C9H10O2,能与NaHCO3溶液反应放出CO2,且苯环上一氯代物有两种的有机物有(不考虑立体异构)
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
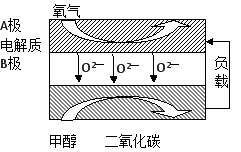
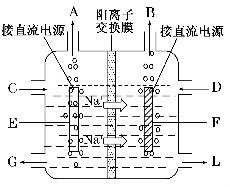
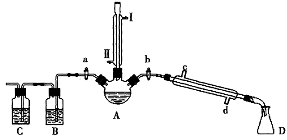
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,正极发生氧化反应,PH减小
难度: 中等查看答案及解析
-
塑化剂是一种对人体有害的物质。增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得:
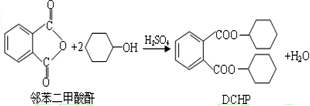
下列说法正确的是
A.环己醇分子中所有的原子可能共平面
B.1mol DCHP可与含4mol NaOH的溶液完全反应
C.DCHP能发生加成、取代反应,不能发生消去反应
D.DCHP易溶于水
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
B.在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子。已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32-
C.在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小
D.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+不能大量共存
难度: 困难查看答案及解析
-
下列说法正确的是
A.7.8克Na2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA
B.用铜做电极电解CuSO4溶液的反应方程式:
2Cu2++2H2O
2Cu+O2↑+4H+
C.常温时,浓度均为0.01mol/L的 Na2CO3溶液和NaHCO3溶液等体积混合,其溶液中粒子浓度关系为 c(CO32-) +c(HCO3-)+c(H2CO3) =0.02mol/L
D.在蒸馏水中滴加浓H2SO4,KW不变
难度: 中等查看答案及解析
-
下表中的实验操作能达到实验目的或能得出相应结论的是
选项 实验操作 实验目的或结论
A 向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加 0.01mol·L-1NaI溶液,产生黄色沉淀。 常温下,
Ksp(AgCl)>Ksp(AgI)
B 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液。 检验KClO3中的氯元素
C 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。 说明原溶液中一定含有CO32- 或 SO32-
D 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。 除去Mg(OH)2样品中的Ca(OH)2
难度: 中等查看答案及解析