-
下列物质中,只含有离子键,不含有共价键的是
A、Na2O2 B、KOH C、MgCl2 D、CO2
难度: 中等查看答案及解析
-
下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
A. 6和8 B. 11和13 C. 11和16 D. 12和17
难度: 中等查看答案及解析
-
当碘升华时,下列各项不发生变化的是
A.分子间距离 B.分子间作用力 C.聚集状态 D.分子内共价键
难度: 中等查看答案及解析
-
下列叙述错误的是
A.离子化合物中不可能存在非极性键
B.含离子键的化合物一定是离子化合物中, 含共价键的化合物不一定是共价化合物
C.共价化合物中一定不含离子键
D.非金属和非金属之间可以形成共价键、也可以形成离子键
难度: 中等查看答案及解析
-
元素性质呈现周期性变化的根本原因是
A.元素的相对原子质量递增,量变引起质变 B.元素原子的核外电子排布呈周期性变化
C.元素的原子半径呈周期性变化 D.元素的化合价呈周期性变化
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.零族元素的单质在常温下都是气体
B.第ⅡA族元素都是金属元素
C.Fe位于周期表的第四周期,第ⅧB族
D.第ⅦA族元素的单质在常温下有气态、液态、固态
难度: 中等查看答案及解析
-
已知短周期元素的离子 A2+,B+,C3-,D- 都具有相同的电子层结构,则下列叙述正确的是
A.单质的还原性A>B>D>C B. 原子序数D>C>B>A
C.原子半径A>B>D>C D.离子半径C>D>B>A
难度: 中等查看答案及解析
-
下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是
A.1mol A 从酸中置换H+生成的H2比1 mol B从酸中置换H+生成的H2多
B.常温时,A能从水中置换出氢,而B不能
C.A原子的最外层电子数比B原子的最外层电子数少
D.A原子电子层数比B原子的电子层数多
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是

难度: 中等查看答案及解析
-
下列关于能源和作为能源物质的叙述中不正确的是
A.人类利用的能源都是通过化学反应获得的
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
难度: 中等查看答案及解析
-
下列各组化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl D.非金属性:F>O>S
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加C的量 B.将容器的体积缩小一半
C.保持体积不变,升高温度 D.压强不变充入N2使容器体积增大
难度: 中等查看答案及解析
-
一定量的Fe与足量的0.5mol∕l盐酸反应,为了加快反应速率,但又不影响产生氢气的总量,应加入下列物质中的
A.NaNO3溶液 B.将Fe改为用同质量的Na
C.改为用同浓度的硫酸 D.CuSO4粉末
难度: 中等查看答案及解析
-
直接提供电能的反应一般是放热反应,下列反应中能提供电能的是
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应 D.H2与Cl2燃烧反应
难度: 中等查看答案及解析
-
反应A+3B=2C+D在四种不同情况下的反应速率分别为:
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.5mol/(L·s)
④v (D) =0.45mol/(L·s) ,则反应进行由快到慢的顺序为:
A.④>③>①>② B.②>④>③>① C.②>③>④>① D.④>③>②>①
难度: 中等查看答案及解析
-
一定温度下,可逆反应2NO2
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;
④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A.②③⑤⑥ B.①④⑤⑥ C.①③④⑥ D.全部
难度: 中等查看答案及解析
-
如图是可逆反应X2 + 3Y2
2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是
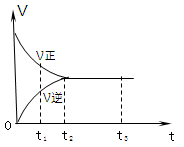
A.t1时,只有正方向反应
B.t2时,反应到达限度且正反应和逆反应速率相等且等于零
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度均没有发生变化
难度: 中等查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:
A. 用物质 A 表示的反应的平均速率为 0.3 mol∕(l·s)
B.用物质 B 表示的反应的平均速率为 0.3 mol∕(l·s)
C.2 s 时物质 A 的转化率为30%
D. 2 s 时物质 B 的浓度为 0.7 mol∕l
难度: 中等查看答案及解析
-
将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是
①使煤充分燃烧,提高煤能的利用率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A、①②③ B、②③④ C、①③④ D、①②③④
难度: 中等查看答案及解析
-
下列说法中正确的是
A.在由Fe、C、CuCl2溶液构成的原电池时,一段时间后Fe棒上将覆盖一层红色物质
B.熔融状态下能导电的物质一定是离子键化合物
C.燃煤发电的能量转变过程可以表示为:
D.阴阳离子间通过静电引力而形成的化学键叫做离子键
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是
A.1.8gNH4+含有的电子数为1.1NA
B.在标准状况下,22.4LHF含有的原子数为2NA
C.2.4g Mg作为还原剂,失去的电子数为0.2NA
D.200mL0.5mol/LNaHCO3溶液中含有的钠离子数为NA
难度: 中等查看答案及解析
-
对于铁、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是
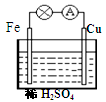
①Fe是负极 ②电子由Fe经外电路流向Cu,后再通过溶液流回到Fe
③Fe -2e-=Fe2+ ④ H+ 在溶液中由Cu棒向Fe棒迁移
⑤一段时间后溶液的PH变大 ⑥一段时间后溶液由无色变为浅绿色
A.①② B.①③⑤⑥ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
氢氧燃料电池用于航天飞船,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下: ①2H2 +4OH—+4e— = 4H2O,②O2+2H2O+4e— = 4OH— 当得到1.8L饮用水时,电池内转移的电子数约为
A.1.8mol B.3.6mol C.100mol D.200mol
难度: 中等查看答案及解析
-
将铁棒和锌棒用导线连接插入硫酸铜溶液中,当电池中有0.4 mol电子通过时,负极的质量变化是
A.增加6.5g B.减少5.6g C.增加11.2g D.减少13g
难度: 中等查看答案及解析