-
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等难度: 中等查看答案及解析
-
由锌.铁.铝.镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是( )
A.锌
B.铁
C.铝
D.镁难度: 中等查看答案及解析
-
欲检验只含一种阴离子的溶液中是否含有SO42-,下列操作中正确的是( )
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
D.先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在难度: 中等查看答案及解析
-
用表示阿伏伽德罗常数,下列说法中正确的( )
A.1L1mol/L的醋酸溶液中离子总数为2NA
B.0.5mol熔融的KHSO4中含有阳离子的数目为1NA
C.
0.4molNaCl晶体中含有图所示的结构单元的数目为0.1NA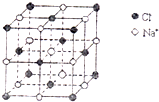
D.标准状况下,22.4LCH2Cl2和CHCl3 的混合物所含有分子数目为NA难度: 中等查看答案及解析
-
若NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.9g重水含有的电子数为5NA
B.1molMgCl2中含有的离子数为NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1molC10H22分子中共价键总数为31 NA难度: 中等查看答案及解析
-
某二价金属的碳酸盐和碳酸氢盐的混合物与足量的盐酸反应,消耗H+和产生CO2的物质的量之比为5:4,则该混合物中碳酸盐与碳酸氢盐的物质的量之比为( )
A.1:3
B.2:3
C.3:4
D.4:5难度: 中等查看答案及解析
-
在由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知硫元素的质量分数为25.6%.则氧元素的质量分数为( )
A.36.8%
B.37.6%
C.51.2%
D.无法计算难度: 中等查看答案及解析
-
在10mL 0.01mol•l-1的纯碱溶液中,不断搅拌并逐滴加入2.4mL 0.05mol•l-1的盐酸,完全反应后,在标准状况下生成CO2的体积为( )
A.1.344 mL
B.2.240 mL
C.0.672 mL
D.0.448 mL难度: 中等查看答案及解析
-
在pH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在的阴离子是( )
①Cl- ②NO3- ③SO42- ④S2-.
A.①②
B.②③
C.③④
D.①③难度: 中等查看答案及解析
-
2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状况下),再向溶液中加入氢氧化钠溶液,生成沉淀的质量最大是( )
A.2.9g
B.4.6g
C.5.5g
D.6.9g难度: 中等查看答案及解析
