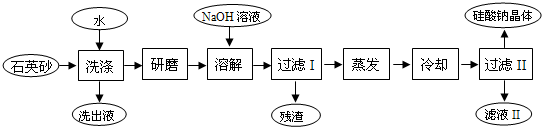
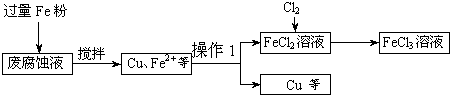
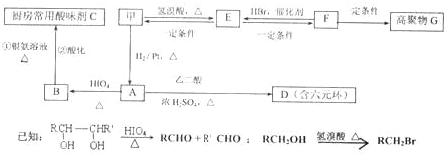
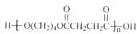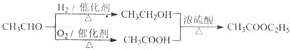-
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A.电解MgC12饱和溶液,可制得金属镁
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.明矾水解形成的A1(OH)3胶体能吸附水中悬浮物,可用于水的净化难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.100mL 1mol/L FeC13溶液中含Fe3+数为0.1NA
B.标准状况下,22.4L SO3中含有氧原子数为3NA
C.0.1mol/L稀硫酸中含SO42-离子个数为0.1NA
D.0.6g CaCO3与Mg3N2的混合物中所含质子数为0.3NA难度: 中等查看答案及解析
-
实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均相等,下面四个选项中能达到此目的是( )
A.Na+、K+、SO42-、Cl-
B.Cu2+、K+、SO42-、NO3-
C.H+、K+、HCO3-、Cl-
D.Mg2+、Na+、Cl-、SO42-难度: 中等查看答案及解析
-
对于反应CaH2+2H2O═Ca(OH)2+2H2↑,有以下判断:
①H2只是氧化产物;
②H2只是还原产物;
③H2O是氧化剂;
④CaH2中的氢元素被还原;
⑤此反应中的氧化产物与还原产物的分子个数之比为1:1.
上述判断正确的是( )
A.③⑤
B.②③
C.①
D.①④⑤难度: 中等查看答案及解析
-
大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )
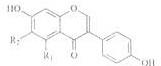
A.可以和溴水反应
B.分子中有两个苯环
C.在碱性条件下容易发生水解
D.1mol大豆异黄酮可以和2molNaOH反应难度: 中等查看答案及解析
-
已知室温时,0.01mo1•L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.加水稀释,溶液的pH增大
B.该溶液由水电离出的c(H+)为10-9mo1•L-1
C.该溶液的pH=4
D.HA与NaOH等物质的量反应的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
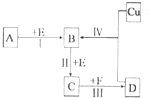
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略),下列说法不正确的是( )
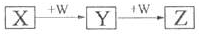
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是氢氧化钠,则X与Z可能反应生成Y
C.若X是金属镁,则W可能是强氧化性的单质
D.若X为甲醇,则X、Z的相对分子质量可能相差14难度: 中等查看答案及解析
-
CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为( )
A.75%
B.25%
C.88%
D.32%难度: 中等查看答案及解析