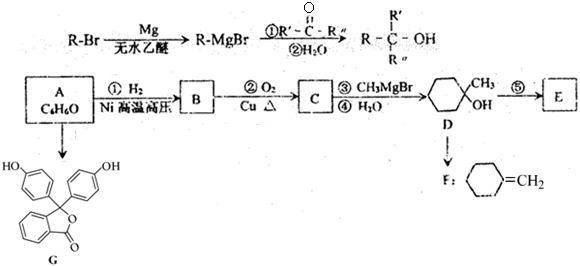
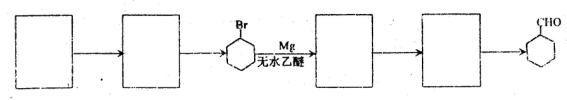
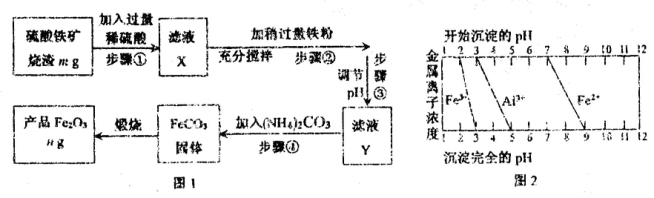
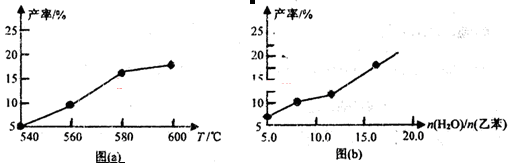
-
化学无处不在,下列与化学有关的说法正确的是( )
A.液氨汽化时能吸收大量的热,故可用作制冷剂
B.SO2能漂白纸浆等,故可广泛用于食品的漂白
C.味精的主要成分是蛋白质,烧菜时可加入适量
D.氢氟酸可用于雕刻玻璃制品,这是利用酸的通性
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=AgOH↓+NH4+
B.向Mg(OH)2悬浊液中滴加FeCl3溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
C.向Na2S2O3溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D.向苯酚钠溶液中通入少量CO2气体:
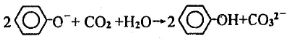
难度: 中等查看答案及解析
-
下列图示实验现象及其解释不正确的是( )
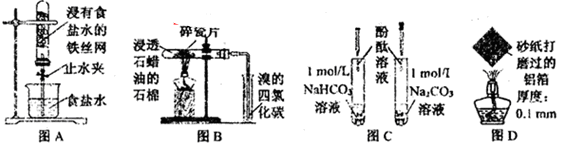
A.图A,一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀
B.图B,加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生
C.图C,溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32-
D.图D,加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高
难度: 中等查看答案及解析
-
下表是常温下的五种溶液,下列有关叙述中正确的是( )
①
②
③
④
⑤
溶液
氨水
氢氧化钠
醋酸
盐酸
醋酸钠
pH
11
11
3
3
8.3
A.表中五种溶液,其中①~④由水电离出的c(H+):②=④>①=③
B.在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+)
C.分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如下图所示转化关系;其中乙和丙均为10电子气体分子,且二者相遇生成弱碱。下列说法正确的是( )
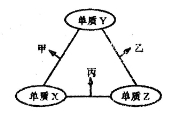
A.X元素位于第ⅣA族
B.热稳定性:乙<丙
C.甲和丙可能发生氧化还原反应
D.分子乙中各原子均达8电子稳定结构
难度: 中等查看答案及解析
-
在容积为2 L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g)
cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
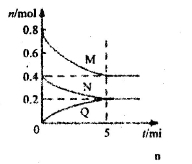
A.该温度下此反应的平衡常数的值K=25/4
B.该反应前5 min的平均速率:v(N)=0.002 mol·L-1·min-1
C.在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆)
D.若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50%
难度: 中等查看答案及解析