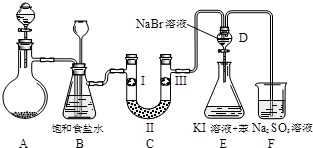
-
将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是( )
A.反应过程中不可能产生H2
B.剩余的金属粉末中一定有铜
C.往反应后的溶液中加入KSCN溶液会变血红色
D.往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少难度: 中等查看答案及解析
-
A、B、C和D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同族元素,其中C中核外电子数是D中核内质子数的2倍.B和D同周期且B的同素异形体之一是原子晶体.下列说法中正确的是( )
A.D元素处于元素周期表中第2周期第Ⅵ族
B.AD2中可能既有离子键又有共价键
C.四种元素的原子半径A>C>D>B
D.BCD分子一定是直线型非极性分子难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2胶体中逐滴加入过量的稀盐酸;③向AgNO3溶液中逐滴加入过量氨水;④向硅酸钠溶液中逐滴加入过量的盐酸( )
A.①②
B.①③
C.①④
D.②③难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.氮的固定只有在高温、高压、催化剂的条件下才能实现
B.纯净的硅单质是制造光导纤维的基本原料
C.高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害
D.发酵粉中含有苏打,能使焙制出的糕点疏松多孔难度: 中等查看答案及解析
-
化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO3NaCl+NaClO4;NaClO4
NaCl+2O2↑
下列说法不正确是( )
A.氧化性(酸性溶液):FeCl3>Co(OH)3>I2
B.还原性(碱性溶液):Fe(OH)2>I2>KIO3
C.热稳定性:NaCl>NaClO4>NaClO
D.酸性(水溶液):HSCN>H2CO3>HCN难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(OH-)/c(H+)=1010的溶液:K+、Fe3+、Cl-、NO3-
B.能生成Al(OH)3的溶液中:Na+、K+、ClO-、SO32-
C.能使酚酞变红的溶液:Na+、Ba2+、NO3-、I-
D.澄清透明的无色溶液:NH4+、K+、MnO4-、SO42-难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.3mol NF3与水完全反应生成HF、HNO3和NO,转移电子数2NA
B.4.4g 14CO2含中子数2.4 NA
C.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA
D.标准状况下22.4L丙烷所含共用电子对数为8NA难度: 中等查看答案及解析
-
由短周期元素组成的中学常见物质A、B、C、D、E、X,存在图中转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
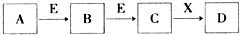
A.若D与盐酸反应,可生成A和B,则X一定是H2O
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C难度: 中等查看答案及解析
-
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q 2均为正值):
H2(g)+Cl2(g)=2HCl(g)△H1=-Q1 kJ•mol-1
H2(g)+Br2(g)=2HBr(g)△H2=-Q2 kJ•mol-1
有关上述反应的叙述正确的是( )
A.Q 1<Q 2
B.生成物总能量均高于反应物总能量
C.1 mol HBr(g)具有的能量高于1 mol HBr(l)具有的能量
D.生成1 mol HCl气体时放出Q 1热量难度: 中等查看答案及解析
-
下列离子方程式表示正确的是( )
A.AgNO3溶液中加入Cu:Cu+Ag+=Cu2++Ag
B.FeCl2溶液中滴加NaClO溶液生成红褐色沉淀:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+
C.甲酸溶液滴到大理石台板上有气泡产生:2H++CaCO3=CO2↑+Ca2++H2O
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O难度: 中等查看答案及解析
-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一.对下列反应的推断或解释正确的是( )
操作 可能的实验现象 解释 A 某溶液中加入硝酸酸化的氯化钡溶液 有白色沉淀生成 溶液中一定含有 B 将SO2通入Ba(NO3)2溶液中 有白色沉淀生成 SO2与Ba(NO3)2反应生成BaSO3 C 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 碳酸钠溶液显碱性,硫酸钠溶液显中性 碳酸钠发生了水解 D 向淀粉KI溶液中通入Cl2 溶液变蓝 Cl2与淀粉发生显色反应
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列实验操作能够达到实验目的是( )

A.实验室采用图①所示装置收集SO2
B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱
C.实验室制取的溴乙烷中常含有少量溴,加适量的苯,振荡、静置后分液,可除去溴乙烷中的溴
D.称取0.40 g NaOH,置于100 mL容量瓶中加水至刻度线,可配制0.10 mol/L NaOH溶液难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )

A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D.Y可能是葡萄糖难度: 中等查看答案及解析
-
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g•cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol.下列叙述中正确的是( )
A.溶质的质量分数为w=×100%
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中c(OH-)=mol•L-1
D.溶质的物质的量浓度c=mol•L-1
难度: 中等查看答案及解析