-
下列有关化学用语使用正确的是
A.乙醇的结构简式:C2H6O
B.NH4Cl的电子式:
C.原子核内有10个中子的氧原子:
D.次氯酸分子结构式 H—Cl—O
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是
A.1L浓度为0.1 mol / L AlCl3溶液中含有的离子数是0.4NA
B.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
C.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
D.标准状况下,1.12L的SO3所含的原子数是0.2 NA
难度: 中等查看答案及解析
-
将甲气体通入BaCl2溶液,未见沉淀生成,然后通入乙气体,有沉淀生成,则甲、乙气体不可能是
A.SO2、H2S B.SO2、NO2 C.NH3、CO2 D.CO2、SO2
难度: 简单查看答案及解析
-
X和Y两元素的阳离子具有相同的电子层结构。X元素的阳离子半径大于Y元素的阳离子半径。Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。则X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B.Z>Y>X C.Z>X>Y D.Y>X>Z
难度: 中等查看答案及解析
-
化学与社会、生产、生活紧切相关,下列说法正确的是
①石英只可用于生产光导纤维,且常温下不与任何酸反应;
②次氯酸钠溶液可用于环境的消毒杀菌;
③黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成;
④用铜片在加热的条件下就可鉴别浓硫酸和稀硫酸;
⑤70mL的H2S和90mL的O2混合点燃后恢复到原状况可产生70mL的SO2;
⑥将过量CO2气体通入水玻璃中可生成硅酸和纯碱
A.①②④⑤ B.①②③④ C.②④⑥ D.②③④
难度: 中等查看答案及解析
-
下列关于某些离子的检验说法正确的是
A.向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3-
B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42-
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+
D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有Cl-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.少量的H2S气体通入硫酸铜溶液中: H2S+Cu2+=CuS↓+2H+
B.将NO2气体通入NaOH溶液中:3NO2+2OH-= 2NO3-+ NO↑+H2O
C.ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中: ICl+2OH-= I-+ ClO-+H2O
D.1.5mol/L 100ml的FeBr2 溶液中通入3.36L(标准状况)Cl2:2Br-+Cl2=Br2+2Cl-
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
浓硝酸在光照下颜色变黄
浓硝酸具有不稳定性
B
浓硫酸具有酸性和吸水性
浓硫酸可使PH试纸先变红后变黑
C
Cl2和SO2均有漂白性
Cl2和SO2均可使含有酚酞的NaOH溶液褪色
D
C的还原性小于Si
可用焦炭和石英在高温下反应制取粗硅和CO
难度: 中等查看答案及解析
-
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是
A.上述反应中,每消耗2mol NO2,就会生成22.4L N2O
B.N2O有氧化性,且为HNO2的酸酐
C.等质量的N2O和CO2含有相等的电子数
D.N2O会迅速与人体血红蛋白结合,使人中毒
难度: 中等查看答案及解析
-
已知下列反应:Co2O3 + 6HCl(浓) = 2CoCl2 + Cl2↑+ 3H2O (I)
5Cl2 + I2 + 6H2O = 10HCl + 2HIO3 (II)
下列说法正确的是
A.反应I中HCl是氧化剂
B.反应II 中Cl2发生氧化反应
C.还原性:CoCl2 > HCl > I2
D.氧化性:Co2O3 > Cl2 >HIO3
难度: 中等查看答案及解析
-
足量的二氧化碳通入到1mol/L NaOH溶液中,下列说法错误的是
A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数)
B.溶液中的CO32—离子浓度先增大后减小
C.微热反应后的溶液,溶液的pH会升高
D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系:
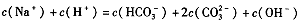
难度: 中等查看答案及解析
-
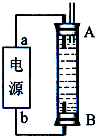
用石墨电极电解CuCl2溶液(见图)。下列分析正确的是
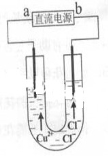
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
难度: 中等查看答案及解析
-
下列实验操作使测定(或配制)结果偏高的是( )
A.配制一定物质的量浓度的溶液,定容时俯视刻度线
B.测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡
C.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释
D.在敞口容器中测量氢氧化钠和稀盐酸反应的中和热
难度: 中等查看答案及解析
-
下列操作中,完全正确的一组是( )
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩ B.①④⑤⑦⑩ C.①④⑤⑦⑧⑩ D.④⑤⑦⑩
难度: 中等查看答案及解析
-
把a L硫酸铵和硝酸铵混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与BaCl2溶液反应恰好消耗c mol BaCl2。原溶液中NO3-的物质的量浓度是( )
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
A.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,转移4NA个电子
B.常温常压下,33.6 L Cl2与56 g Fe充分反应,转移电子数为3NA
C.标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.在1 L 0.2 mol·L-1的硫酸铁溶液中含有的铁离子数为0.4NA
难度: 中等查看答案及解析
-
向一定量的Fe、Fe0、Fe304的混合物中加人100mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,生成224 mL(标准状况)气体,向溶液中滴加KSCN溶液无红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为
A.2.8 g B.5.6 g C.11.2 g D.无法计算
难度: 中等查看答案及解析
-
关于如图所示各装置的叙述中,正确的是
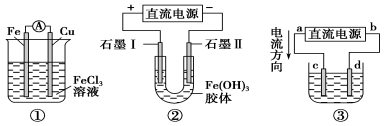
A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是 ( )
A.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++2OH-+NH4++HCO3- = BaCO3↓+NH3·H2O+H2O
C.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
D.过量CO2通入氢氧化钠溶液中 CO2+2OH- = CO32-+H2O
难度: 中等查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-13mol/L,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、SO42-
C.K+、Na+、Cl-、CO32- D.K+、I-、NO3-、Cl-
难度: 中等查看答案及解析
-
某高分子化合物是制造彩电荧光屏的原料之一,其结构简式为:
 下列有关该高分子化合物的说法不正确的是
下列有关该高分子化合物的说法不正确的是A.不易溶于水 B.可以发生酯化反应
C.可以发生加成反应 D.水解后能得到分子式为
C9H8O2的产物
难度: 中等查看答案及解析
-
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A.8∶11 B.3∶5 C.1∶2 D.18∶8
难度: 中等查看答案及解析
-
如图所示,夹子开始处于关闭状态,将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是( )
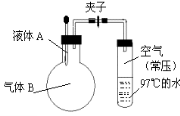
A.水、氯化氢
B.硫酸、氨气
C.氢氧化钠溶液、二氧化硫
D.氢氧化钠溶液、一氧化碳
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) △H=a、2C(s)+O2(g)=2CO(g) △H=b,则a>b
D.已知P (白磷,s)=P (红磷,s) △H<0,则白磷比红磷稳定
难度: 中等查看答案及解析
-
25℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得
c(Na+)>c(A-),则下列描述中,不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mo1+n(H+)
难度: 中等查看答案及解析
 )的路线如下:
)的路线如下: