-
下列每组中各物质内既有离子键又有共价键的一组是
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
难度: 中等查看答案及解析
-
下列说法正确的是
A.光导纤维的主要成分是硅
B.水晶项链是硅单质制品
C.利用盐酸刻蚀石英制作艺术品
D.硅酸钠是制备木材防火剂的原料
难度: 简单查看答案及解析
-
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWüthrich等人为此获得2002年诺贝尔化学奖。下面叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N的核外电子数与中子数相同 D.15N与14N是N元素的两种同位素
难度: 中等查看答案及解析
-
原子结构决定元素的性质,下列说法中正确的是
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的是H2O
C.第二周期元素的最高正化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
难度: 中等查看答案及解析
-
氯气是一种重要的工业原料。工业上利用反应3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气则遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.实验室可用 NH4Cl受热分解制取NH3
D.生成1 molN2有6 mol电子转移
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合物如表所示:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+3、+5、-3
-2
下列叙述正确的是
A.Z的最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.相同条件下,X、Y的单质分别与盐酸反应时,后者反应剧烈些
难度: 中等查看答案及解析
-
现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,如果只用一种试剂把它们区别开来,这种试剂是
A.氨水 B.AgNO3 C.NaOH D.H2SO4
难度: 中等查看答案及解析
-
下列实验不能达到预期目的的是
A
Cl2、Br2分别与H2反应
比较氯、溴的非金属性强弱
B
MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
C
NaCO3溶液中加入稀H2SO4
比较碳、硫的非金属性强弱
D
Fe、Cu分别与盐酸反应
比较铁、铜的金属性强弱
难度: 中等查看答案及解析
-
下列陈述I、陈述II均正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
SO2能使溴水褪色
SO2具有还原性
B
NH3能使酚酞溶液变红
NH3可用于设计喷泉
C
SiO2能与氢氟酸、碱反应
SiO2是两性氧化物
D
晶体Si熔点高硬度大
晶体Si可用作半导体材料
难度: 中等查看答案及解析
-
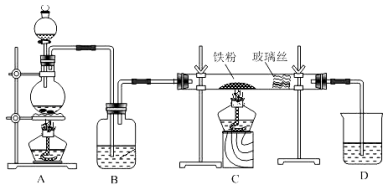
实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项
A中的物质
B中的物质
C中收集的气体
D中的物质
A
浓氨水
CaO
NH3
H2O
B
浓盐酸
MnO2
Cl2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓硫酸
Na2SO3
SO2
NaOH溶液
难度: 困难查看答案及解析
-
NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成NA个H2分子
B.23gNO2和N2O4混合气体中含有原子总数为1.5NA
C.足量Cu和100mL18mol/L热浓硫酸反应可生成0.9 NA个SO2分子
D.3mol单质Fe完全转变为Fe3O4,失去9 NA个电子
难度: 困难查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、AlO2-、SO42-、Cl-
B.使紫色石蕊试纸变红的溶液中:K+、Fe2+、NO32-、Ca2-
C.与Al反应能放出H2的溶液中:Na+、K+、NO3-、HCO3-
D.显强酸性的溶液中: Na+、SO42-、ClO-、Cl-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.过氧化钠反应生成NaOH和O2:Na2O2+H2O=2Na++2OH-+O2↑
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 中等查看答案及解析
-
“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
①钠与水反应生成NaOH和H2,所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④Al(OH)2能与NaOH反应,Be(OH)2也能与NaOH反应
A.①③ B.②④ C.①② D.①②④
难度: 中等查看答案及解析
-
将64g铜与一定浓度的浓硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为33.6L,欲使反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要40%的双氧水的质量为
A.85g B.79g C.116g D.58g
难度: 困难查看答案及解析
-
一定量的氢气在氯气中燃烧,所得混合物冷却后用500mL 0.6mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,参加反应的氢气和所用氯气的物质的量之比为
A.3:1 B.3:2 C.2:3 D.3:4
难度: 困难查看答案及解析