-
化学与人类生活、能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.推广燃煤脱硫技术,可以防治SO2、CO的污染
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.无论是风力发电还是潮汐发电,都是将化学能转化为电能
D.垃圾是放错地方的资源,应分类回收利用
难度: 简单查看答案及解析
-
下列说法正确的是
A.活化分子间所发生的碰撞为有效碰撞
B.增大反应物浓度,可增大活
化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子百分数
D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大
难度: 中等查看答案及解析
-
在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放置在漫散光的地方,两种气体发生反应后恢复到原温度。下列叙述中不正确的是
A.容器内原子总数不变
B.容器内分子总数不变
C.容器内压强不变
D.反应后得到的产物为混合物
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如右图的转化关系。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述错误的是
A.18 g H2O中含有的质子数为10NA
B.标准状况下,2.24 L己烷含有分子的数目为0.1NA
C.46 g NO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
难度: 中等查看答案及解析
-
在密闭容器中,A和B反应生成C,其反应速率分别用v(A)、v (B)、v (C)表示,已知它们之间的如下关系:3v (A)=2v (B),3v (C)=2v (B)。则此反应可表示为
A.3A+2B = 2C B.2A+3B = 2C C.3A+ 2B = 3C D.A + B = C
难度: 简单查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.往K2CrO4溶液中加酸,使溶液橙色加深
D.Fe(SCN)3溶液中加入几滴6mol/L NaOH溶液后溶液颜色变浅
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.元素氧化物对应水化物的酸性:Z>Y
C.元素形成的单核阴离子还原性:X>Y
D.Z元素单质在化学反应中只表现氧化性
难度: 中等查看答案及解析
-
一定温度下,反应2SO2 + O2
2SO3,达到平衡时,n(SO2):n(O2):n(SO3) =2:3:4。缩小体积,反应再次达到平衡时,n(SO2)=0.4mol,n(SO3)=1.4mol,此时O2的物质的量应是
A.0.4mol B、0.6mol C、0.8mol D、1.2mol
难度: 简单查看答案及解析
-
白磷在氧气中燃烧的反应为:P4 + 5O2 = P4O10。已知下列化学键的键能分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据,下列推断正确的是

A.6a+5d < 4c + 10b
B.△H = (4c+12b-6a-5d) kJ·mol-1
C.6a+5d > 4c + 12b
D.△H = (6a+5d-4c-12b) kJ·mol-1
难度: 中等查看答案及解析
-
下列关于能量的变化及反应热的说法中正确的是
A.需要加热才能发生的反应都是吸热反应
B.已知1mol CO(g)完全燃烧时放出283.0kJ热量,则表示CO(g)燃烧热的热化学方程式为 2CO(g)+ O2(g)═2CO2(g);∆H =﹣566.0k
J/mol
C.∆H < 0、∆S < 0的反应肯定是自发的
D.任何化学反应都有反应热
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.戊烷(C5H12)有两种同分异构体
C.氰酸铵(NH4OCN)与尿素[CO(NH2)2]都是共价化合物
D.糖类、油脂和蛋白质均可发生水解反应
难度: 简单查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化如右图所示,下列说法正确的是
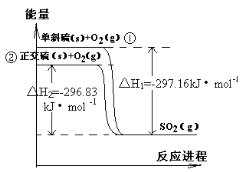
A.S(s,单斜) = S(s,正交) △H = +0.33kJ/mol
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量
难度: 中等查看答案及解析
-
等质量的两份锌粉a、b,分别加入到过量的稀硫酸溶液中,并且在a中加入少量的CuSO4,下图中表示其产生H2总体积(V)与时间(t)的关系正确的是

难度: 简单查看答案及解析
-
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、CO32-、HCO3-、Br-等离子。火力发电燃煤排放的含有SO2的烟气可利用海水脱硫,其工艺流程如下所示:

下列说法错误的是:
A.含SO2的烟气若不经过海水脱硫直接排放可造成酸性降雨
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
难度: 困难查看答案及解析
-
已知(HF)2 (g)
2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是

A.温度: T1<T2
B.平衡常数:K(b)<K(c)
C.反应速率:vb>va
D.当m总/n总 = 30g/mol时,n(HF):n[(HF)2]=2:1
难度: 中等查看答案及解析
-
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆
反应:2SO2(g)+O2(g)
2SO3(g)△H = -197kJ/mol。实验测得起始、平衡时的有关数据如右表所示。下列叙述正确的是
容器
起始各物质的物质的量/mol
达到平衡时体
系能量的变化
SO2
O2
SO3
Ar
甲
2
1
0
0
放出热量:Q1
乙
1.8
0.9
0.2
0
放出热量:Q2
丙
1.8
0.9
0.2
0.1
放出热量:Q3
A.Q1=Q2=Q3
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.若在上述条件下反应生成2molSO3(s)的放热大于197kJ
难度: 困难查看答案及解析