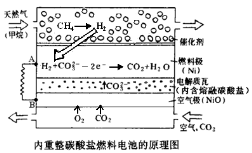
-
下列各组物质中,每一种物质都能使氯水褪色的是( )
A.AgNO3溶液、CCl4、BaCl2溶液
B.Na2SO3溶液、FeCl3溶液、H2S溶液
C.SO2气体、KOH溶液、镁粉
D.NaOH溶液、CO气体、石蕊溶液
难度: 简单查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法。下列有关物质分类或归类正确的是( )
①混合物:漂白粉、水玻璃、Fe(OH)3胶体、冰水混合物
②化合物:CaCl2、NaOH、HCl、HT[
③同素异形体:C60、碳纳米管、金刚石、石墨
④电解质:胆矾、苛性钠、冰醋酸、氧化钾
⑤煤的干馏、煤的汽化和煤的液化都属于化学变化
⑥硅酸盐:光导纤维、水晶、玻璃、水玻璃
A.①②④⑤ B.③④⑤ C.③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
下列物质中不能用化合反应的方法制得的是( )
①SiO2 ②H2SiO3 ③Fe(OH)3 ④CuS ⑤FeCl2 ⑥ CaSiO3
A.②④ B. ②④⑤ C.②③④⑤ D.②④⑥
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是( )

A.用图1装置制取并收集干燥的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用铜作电极电解饱和食盐水:2Cl-+2H2O
2OH-+Cl2↑+H2↑
B.Fe3O4与过量的稀HNO3反应: Fe3O4+8H+ =Fe2++2Fe3++4H2O
C.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.NaHS溶液呈碱性:HS-+H2O
H3O++OH-+ S2-
难度: 中等查看答案及解析
-
某物质的分子式为CxHyOz,取该物质ag在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了bg,并且a<b,则x、y、z必须满足的关系是( )
A.x>z B.x=y=z C.x=z D.x<z
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项正确的是( )
序号
反应物
产物
①
KMnO4、H2O2 、H2SO4
K2SO4 、MnSO4 ..
②
Cl2 、FeBr2
FeCl3 、Br2
③
MnO2......
Cl2 、Mn2+ ...
A.第①组反应的其余产物为H2O
B.第③组反应中生成1mol Cl2,转移电子4mol
C.氧化性由强到弱顺序为MnO4- > Fe3+>Cl2 >Br2
D.第②组反应中Cl2 与 FeBr2的物质的量之比为3:2
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
B.在含有0.1mol·L-1 Fe3+的溶液中:SCN-、Cl-、K+不能大量共存
C.在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,
CH3COO-浓度变化最小
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
难度: 困难查看答案及解析
-
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
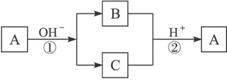
A.X元素可能为Al B.X元素可能为金属,也可能为非金属
C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应
难度: 困难查看答案及解析
-
将几滴KSCN(SCN-是“类似卤离子”)溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。下列说法中不正确的是( )
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪色的原因是SO2将Fe3+还原为Fe2+
C.②中红色褪色的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
难度: 困难查看答案及解析
-
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
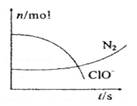
A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是( )
A.向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
D.硫酸亚铁溶液加过氧化氢溶液:Fe2++H2O2+2H+=Fe3++2H2O
难度: 中等查看答案及解析
-
(l)
=H2O(g) △H1=a kJ·
(2)
=2H2O(g) △H2=b kJ·
(3)
=H2O(l) △H3=c kJ·
(4)
=2H2O(l) △H4=d kJ·
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 中等查看答案及解析
-
关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
难度: 简单查看答案及解析
-
目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na+ 导电的β—Al2O3陶瓷作固体电解质,反应如下:2Na+xS
Na2Sx,以下说法正确的是( )
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生还原反应
C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D.充电时,阳极发生的反应是Sx 2--2e-= xS
难度: 困难查看答案及解析
-
甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是( )
A.参加反应的H2SO4为0.2mol B.参加反应的NaOH约为0.27mol
C.加入铝粉的质量A=5.4 D.与硫酸反应的铝粉的质量7.2g
难度: 困难查看答案及解析
-
在Na+浓度为0.9 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子:取该溶液100ml进行如下实验(气体体积在标准状况下测定):
阳离子
K+、Ag+、Mg2+、Ba2+
阴离子
NO3-、CO32-、SiO32-、SO42-
I.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体;II.将I的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6g;III.在II的滤液中滴加BaCl2溶液,无明显现象,下列说法不正确的是( )
A.K+一定存在,且c(K+)≤1.3mol·L-1
B.实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+
C.实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓
D.实验III能确定一定不存在SO42-
难度: 困难查看答案及解析
-
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列对应的曲线错误的是( )
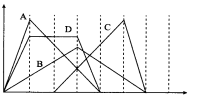
A.向NaAlO2溶液中滴入HC1至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
难度: 困难查看答案及解析
-
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
难度: 困难查看答案及解析
-
已经部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,经如下处理:

下列说法不正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+
②V=224mL ③V=336mL
④样品中含氧元素的物质的量为0.03mol
⑤溶解样品的过程中消耗硫酸的总物质的量为0.04mol
A.①③ B.①③④ C.②④⑤ D.③④⑤
难度: 困难查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是( )
A.在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2: Ba(OH)2、KOH、K2CO3、BaCO3
B.在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3
C.在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:OH-、AlO2-、Al(OH)3、CO32-
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+
难度: 困难查看答案及解析
-
按下图所示装置进行实验,若x轴表示流入阴极的电子的物质的量,则y轴应表示( )

①c(Ag+) ②c(NO
) ③a棒的质量
④b棒的质量 ⑤c(H+)
A.①③ B.③④ C.①②④ D.①②⑤
难度: 中等查看答案及解析
-
实验发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
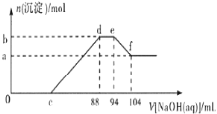
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应NaOH溶液的体积为48 mL
C.b点与a点的差值为0.05 mol
D.样品中铝粉和铁粉的物质的量之比为5:3
难度: 困难查看答案及解析
-
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )。
A.Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1源
D.Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
难度: 中等查看答案及解析