-
下列物质分类正确的是( )
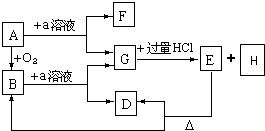
A B C D 酸 HCl气体 硫酸 醋酸 盐酸 碱 熟石灰 烧碱 纯碱 NH3•H2O 盐 小苏打 胆矾 碱式碳酸铜 NaHSO4 氧化物 水 过氧化氢 Al2O3 KClO3 电解质 Cl2 液态HCl NaCl溶液 H2O
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容量 ④压强⑤刻度线 ⑥酸式或碱式这六项中的( )
A.②④⑥
B.③⑤⑥
C.①②④
D.①③⑤难度: 中等查看答案及解析
-
为确定某溶液的离子组成,分别进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
A.一定有SO32-离子
B.一定有CO32-离子
C.一定有Cl-离子存在
D.不能确定HCO3-离子是否存在难度: 中等查看答案及解析
-
“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
A.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体难度: 中等查看答案及解析
-
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源、金属钠为还原剂,在470℃、80Mpa下合成金刚石,具有深远意义.下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化
B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠
D.金刚石的熔点高、硬度大难度: 中等查看答案及解析
-
使用化学手段可以消除某些环境污染.下列主要依靠化学手段消除环境污染的是( )
A.在燃煤中添加生石灰
B.将某些废旧塑料融化后再成型
C.把放射性核废料深埋于地下岩层
D.用多孔吸附剂清除水面油污难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,1 mol氦气含有的核外电子数为4NA
B.1mol的1H37Cl分子所含中子数为18NA
C.同温同压同体积的氢气和氧气有相同的分子数
D.常温时1 L 1mol/L的醋酸溶液中,所含醋酸分子数为NA难度: 中等查看答案及解析
-
如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )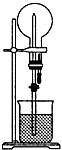
A.CO2(NaHCO3)溶液/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑
难度: 中等查看答案及解析
-
下列各组离子在给定条件下能大量共存的是( )
A.在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、Al3+、Cl-、NO3-
B.有大量存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO32-、S2-、Na+、K+难度: 中等查看答案及解析
-
两个体积相同的容器,一个盛有NO,另一个盛有N2和O2(N2和O2间未发生化学反应).在同温同压下,两容器内的气体一定具有相同的( )
A.原子总数
B.质子总数
C.中子总数
D.质量难度: 中等查看答案及解析
-
浅绿色的Fe(NO3)2溶液中,存在水解平衡:Fe2++2H2O⇌Fe(OH)2+2H+.若在此溶液中加入盐酸,则溶液颜色( )
A.浅绿色略变深
B.颜色基本不变
C.变为红褐色
D.变黄难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.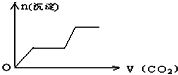
B.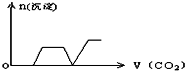
C.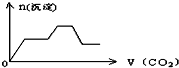
D.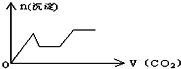
难度: 中等查看答案及解析
-
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )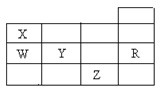
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强难度: 中等查看答案及解析
-
下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CsCl CBr4 CF4
B.NaCl CsCl H2S NH3
C.金刚石 晶体硅 二氧化硅 碳化硅
D.Cs K Na Li难度: 中等查看答案及解析
-
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol•L-1的NaOH溶液300mL,金属离子完全沉淀.则形成沉淀的质量是( )
A.43.2g
B.46.8g
C.53.6g
D.63.8g难度: 中等查看答案及解析