-
下列有关叙述正确的是
A.Na2O·SiO2是一种简单的硅酸盐,可溶于水
B.严重影响我国北方的霾尘,其颗粒物是种胶体
C.稀硫酸、NaCl溶液是实验室常见的电解质
D.酸性氧化物均能与水反应生成对应的酸,如CO2、SO3等
难度: 中等查看答案及解析
-
对于几种常见的有机物:甲烷、苯、乙醇、葡萄糖,下列有关说法错误的是
A.它们都能发生氧化反应,氧化产物可能相同也可能不同
B.甲烷、乙醇均可代替汽油作车用燃料,清洁环保
C.乙醇、葡萄糖都能溶于水,都能和水分子形成氢键
D.相同质量苯、乙醇分别与氧气完全燃烧,后者耗氧量大
难度: 中等查看答案及解析
-
下列实验操作导致所读出的数值比真实值小的是(假设其他操作均正确)
A.对滴定管仰视读数:23.80mL
B.将胆矾置于托盘天平右盘称量所得质量10.4g(左盘砝码10g,游码0.4g)
C.中和热测定时用铜棒代替环形玻璃搅拌棒搅拌,测定反应的最高温度:30.4℃
D.用量简量取硝酸时,俯视读数:5.8mL
难度: 中等查看答案及解析
-
下列有关反应的叙述正确的是
A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应
B.NH3+H3O+=NH4++H2O说明结合H+的能力H2O>NH3
C.FeCl2、Fe(OH)3均可通过化合反应制得
D.分子式为C2H4O2的化合物只能电离,不能水解
难度: 中等查看答案及解析
-
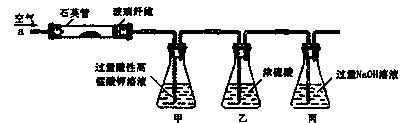
关于下图电化学装置中的电极名称、材料及反应均可能正确的是
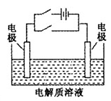
A.阴极(Cu片)2C1――2e-=Cl2↑
B.正极(石墨棒):Fe3+ +e-= Fe2+
C.阳极(Cu片):4OH――4e-=2H2O+O2↑
D.负极(Fe钉):Fe-3e-=Fe3+
难度: 中等查看答案及解析
-
常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:2混合后溶于水配成稀溶液,下列有关该混合溶液说法正确的是
A.溶液中c(CO32-):c(HCO3-)<1:2
B.溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
C.向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少
D.将混合液蒸干,水解加剧,最终得NaOH固体
难度: 中等查看答案及解析
-
M、N为短周期的两种元素,M元素原于的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其有关说法正确的是
A.M、N可能为金属
B.若M、N为同周期元素,则原于半径M<N
C.M、N元素的单质可能与水发生置换反应
D.M、N形成的离子化合物不能体现强氧化性
难度: 中等查看答案及解析
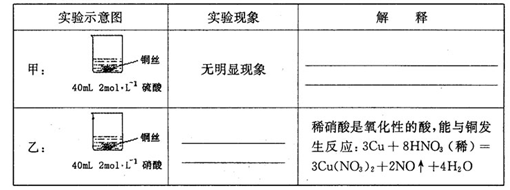
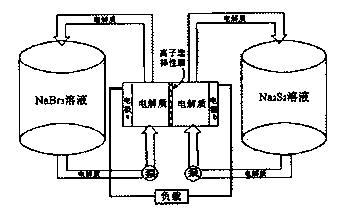
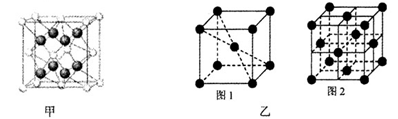
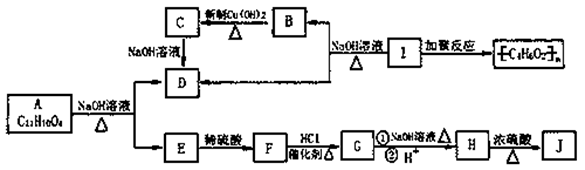
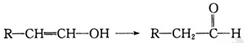 化学式为C11H10O4的有机物A有如下的转化关系
化学式为C11H10O4的有机物A有如下的转化关系