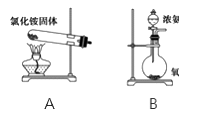
-
化学与生产、生活密切相关。下列说法错误的是
A. 二氧化氮能使织物褪色,对金属材料也有腐蚀作用
B. 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
C. 明巩[KAl(SO4)2·12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 干冰、液态氯化氢都是电解质
B. Na2O2晶体中既含苻离子键又含有共价键
C. Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
D. 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
难度: 中等查看答案及解析
-
下列关于
的说法正确的是
A.
和
的质子数相同,互称为同位素
B.
和
的中子数相同,互称为同位素
C.
和
的核外电子数相同,是同一种核素
D.
和
的质量数不同,不能互称为同位素
难度: 中等查看答案及解析
-
下列说法不合理的是
A. FeCl3、Na2O2、CuS均可由相应单质直接化合生成
B. 在称硫酸中加入铜粉,铜粉不溶解,若加入KNO3晶体,铜粉溶解
C. “溶洞”的形成过程中发生了碳酸钙与水、CO2的反应
D. 氢氧化铝、碳酸铵都既能与盐酸反应,又能与氢氧化钠瑢液反应
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
A. 无色洛液中:K+、Na+、MnO4-、SO42-
B. 含大量Fe2+溶液中:K+、Cl-、NO3-、Na+
C. 加入Al能产生H2的溶液中:I-、NO3-、SO42-、NH4+
D. 在酸性溶液中:NH4+、Na+、Cu2+、ClO-
难度: 困难查看答案及解析
-
下列有关实验的做法错误的是
A. 分液时,分液漏斗中的上层液体应由上口倒出
B. 用加热的方法可区分碳酸钠和碳酸氢钠两种固体
C. 用渗析的方法可除去Fe(OH)3胶体中混有的C1-
D. 加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
难度: 困难查看答案及解析
-
下列各组反应最终有白色沉淀生成的是
①金属纳投入到FeCl2溶液中②过量NaOH溶液和AlCl3溶液混合
③少量Ca(OH)2投入NaHCO3溶液中④过量CO2通入Na[Al(OH)4]溶液中
A. ②③ B. ③④ C. ①③④ D. ①②③④
难度: 困难查看答案及解析
-
下列说法正确的是
A. 电子层结构相同的微粒,其化学性质—定相似
B. 第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 非金属元素的原子两两结合形成的化合物不一定是共价化合物
D. 元素周期律是元素原子核外电子排布周期性变化的结果
难度: 中等查看答案及解析
-
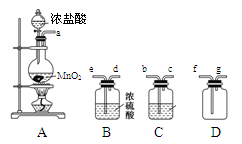
下列实验或实验操作达到实验目的的是
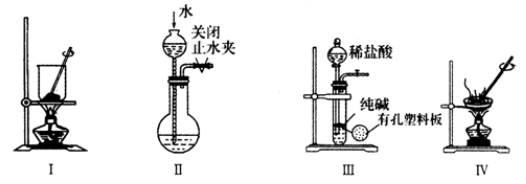
A. 图I:将海带灼烧成灰 B. 图II:检验装置的气密性
C. 图Ⅲ:制取少量纯净的CO2气体 D. 图IV:蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 困难查看答案及解析
-
设NA为阿伏加徳罗常数的值,下列说法中正确的是
A. 62gNa2O溶液于水后所得溶液中含有的O2-数为NA
B. 标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA
C. 常温常压下,16g甲烷(12C1H4)所含的中子数为10NA
D. 常温常压下,14g由N2和CO组成的混合气体含有的原子数目为NA
难度: 困难查看答案及解析
-
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示:
阳离子
NH4+、Na+、Mg2+
阴离子
OH-、NO3-、Cl-
取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),則乙物质可能是①MgCl2 ②NaOH ③NH4Cl ④Mg(NO3)2 ⑤NH4NO3
A. ①② B. ③④ C. ③⑤ D. ①⑤
难度: 困难查看答案及解析
-
下列表述或化学用语书写正确的是
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2+ +OH-+H++SO42-=BaSO4↓+H2O
B. 稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑
C. FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 金属铝与氧化镁发生铝热反应:2Al+3MgO
3Mg+Al2O3
难度: 困难查看答案及解析
-
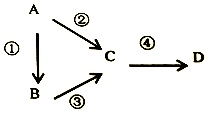
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素。
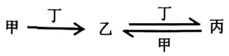
下列推断错误的是
A. 若甲为焦炭,則丁可能是O2 B. 若甲为N2,则丙可能是NO2
C. 若甲为Cl2,则丁可能是Fe D. 若甲为NaOH溶液,则丁可能是CO2
难度: 困难查看答案及解析
-
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素。下列说法错误的是
W
Z
X
Y
A. 原子半径:Z<W<Y<X B. 元素Y的氧化物能与NaOH溶液反应
C. 最简单气态氢化物的热稳定性:Y<X D. W、Z的氧化物都能与碱反应生成盐和水
难度: 中等查看答案及解析
-
水溶液X中只可能溶有K+、Mg2+、 Al3+、[Al(OH)4]-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:

下列判断错误的是
A. 气体甲可能是混合物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. 白色沉淀乙的主要成分是氢氧化铝
D. K+、[Al(OH)4]-和SiO32-一定存在于溶液X中
难度: 困难查看答案及解析
-
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42- +2Fe2++4H+
②Cr2O72-+6Fe2+ + 14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
A. 氧化性Cr2O72->Fe3+> SO2
B. 能将Na2SO3氧化成Na2SO4
C. 每有lmolK2Cr2O7参加反应,转移电子的数目为3NA
D. 若6.72L SO2 (标准状况)参加反应,则最终消耗0.1mol K2Cr2O7
难度: 中等查看答案及解析