-
下列各组说法一定正确的是( )
A.强电解质:盐酸、氢氧化钡、明矾
B.纯净物:冰水混合物;含氧40%的氧化镁
C.有单质参加和单质生成的化学反应一定是氧化还原反应
D.同位素:H2、D2、T2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,N表示粒子数目,下列叙述不正确的是( )
A.标准状况下,22.4 LHF中分子总数为NA
B.室温下,31.0g白磷中含有的共价键数目为1.5NA
C.常温常压下,17 g甲基(﹣14CH3)所含的电子数为9NA
D.将1molCl2通入到水中,则N(HClO)+N(Cl﹣)+N(ClO﹣)=2NA
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A.NaHS溶液水解的方程式为:HS﹣+H2O
S2﹣+H3O+
B.向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH﹣+18O2↑
C.在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl-
D.用惰性电极电解饱和氯化钠溶液:2Cl﹣+2H+
H2↑+Cl2↑
难度: 困难查看答案及解析
-
密闭容器中盛有一定量的CH4与O2混合气体及足量的Na2O2固体,电火花点燃充分反应后,恢复至室温,发现容器为真空,则原混合气中CH4与O2的体积比为( )
A.2:1 B.1:2 C.1:1 D.任意比
难度: 困难查看答案及解析
-
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
Na
Cu
Al
Fe
熔点(℃)
97.5
1083
660
1535
沸点(℃)
883
2595
2200
3000
根据以上数据判断其中不能形成合金的是( )
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
难度: 中等查看答案及解析
-
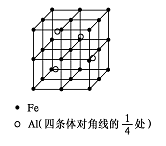
现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为(提示:Si+2OH-+H2O===SiO
+2H2↑)( )
A.Al、Mg、Si、Zn B.Al、Fe、Zn、Na
C.Al、Na、Cu、Fe D.Al、Cu、Mg、Si、Mn
难度: 中等查看答案及解析
-
将足量CO2分别通入下列各溶液中,所含离子仍能大量共存的是( )
A.NH
、Al3+、SO
、H+
B.Na+、CH3COO-、C6H5O-、HCO
C.Na+、ClO-、SO
、Cl-
D.K+、AlO
、Cl-、NO
难度: 中等查看答案及解析
-
根据如图可判断下列离子方程式中错误的是( )
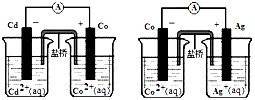
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
难度: 中等查看答案及解析
-
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:

下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验方案Ⅱ更便于实施
难度: 困难查看答案及解析
-
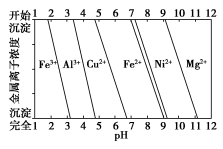
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
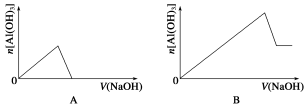
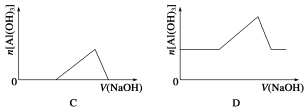
难度: 困难查看答案及解析
-
a mol的下列铁及其化合物分别与足量的稀硝酸反应(假设还原产物只有一种),消耗硝酸的物质的量均可看作两部分,一部分为作氧化剂的硝酸,另一部分为起酸作用的(即以硝酸根离子的形式存在于反应后的溶液中维持溶液的电中性
)硝酸,下列各选项中消耗的
硝酸的物质的量正确的是(单位:mol)( )
①Fe:3a+a;②Fe3O4:9a+a\3;③Fe(OH)2:3a+a/3;④FeSO4:a+a\3
A.①②③④ B.只有①② C.只有③④ D.只有①②③
难度: 困难查看答案及解析
-
①热分解法、②热还原法、③电解法是工业上制取金属的三种常用方法。下列金属与冶炼方法相对应的是( )
选项
金属
冶炼方法
A
K、Na
③
B
Ca、Cu
②
C
Fe、Mg
③
D
Al、Hg
①
难度: 中等查看答案及解析
-
一定条件下,下列物质可通过化
合反应制得的共有( )
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤氢氧化铜 ⑥氢氧化铁
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
用FeCl3溶液腐蚀印
刷电路板上的铜,所得的溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是( )
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
难度: 中等查看答案及解析
-
足量的
铜溶于一定量浓HNO3中,产生NO、N2O4 NO2的混合气体,这些气体若与1.12 LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5mol.L的H2SO4溶液100mL,则继续溶解的铜的质量
A.6.4g B.9.6g C.19.2g D.24g
难度: 困难查看答案及解析
-
某溶液可能含有Cl-、SO
、CO
、NH
、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C.SO
、NH
一定存在,Cl-可能不存在
D.CO
、Al3+一定不存在,K+可能存在
难度: 困难查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期元素.其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构.下列说法正确的是( )
A. X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X
B. 在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C. X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
D. 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
难度: 困难查看答案及解析
-
下列实验操作及现象能够达到对应实验目的是( )
选项
实验操作及现象
实验目的
A
将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色
验证亚硫酸的不稳定性
B
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生
证明常温下
Ksp(BaCO3)>Ksp(BaSO4)
C
常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH
证明相同条件下,在水溶液中HCl电离程度大于CH3COOH
D
将浓硫酸与碳混合加热,直接将生成的气体通入足量的石灰水,石灰水变浑浊
检验气体产物CO2的存在
难度: 困难查看答案及解析
-
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液 ④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
难度: 中等查看答案及解析
-
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是( )
(甲) XO3n﹣+Xn﹣+H+→X单质+H2O(未配平); (乙)Mm++mOH﹣=M(OH)m↓
①若n=1,则XO3n﹣中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m.
A.①③ B.②③ C.①② D.④⑤
难度: 困难查看答案及解析
-
下列图示与对应的叙述不相符的是( )
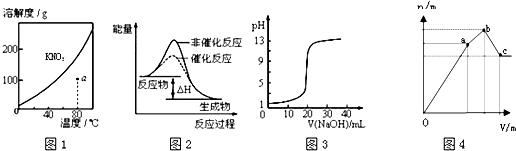
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol•L﹣1NaOH溶液滴定20.00mL0.1000mol•L﹣1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
难度: 极难查看答案及解析
-
1.52g铜镁合金完全溶解于50mL密度为1.40g•mL﹣1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0mol•L﹣1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是1:2
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol•L﹣1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
难度: 困难查看答案及解析
-
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A.b点时,CO的转化率为20%
B.容器内的压强保持恒定,表明反应达到平衡状态
C.b点和d点的化学平衡常数:Kb>Kd
D.0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
难度: 困难查看答案及解析
-
某化学研究性学习小组对溶液作如下的归纳总结(均在常温下).其中正确的是( )
①pH=3的强酸溶液1mL,加水稀释
至100mL后,溶液pH降低2个单位
②1L 0.50mol•L﹣1NH4Cl 溶液与2L 0.25mol•L﹣1 NH4Cl 溶液含NH4+ 物质的量前者大
③在某钠盐溶液中含有等物质的量的Cl﹣、I﹣、AlO2﹣、CO32﹣、NO3﹣、SiO32﹣中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32﹣
④pH=4、浓度均为0.1mol•L﹣1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO﹣)﹣c(CH3COOH)=2×(10﹣4﹣10﹣10) mol/L.
A.①② B.②③ C.①③ D.②④
难度: 困难查看答案及解析
-
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol·L-1的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,测得溶液中含盐酸盐溶质共W2 g。下列所列关系式中正确的是( )
A.35.5a=(W2-W1)V2
B.n(Na)+3n(Al)=
mol
C.n(Al)>
mol
D.aV2>
难度: 困难查看答案及解析