-
锎是锕系中的一种元素,1 mg锎(
)每秒钟约能释放出2.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关说法错误的是 ( )
A.
中,质子数和电子数均为98 B.
和
互为同位素
C. 锎位于元素周期表第六周期 D.
的中子数与质子数之差为56
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 元素的相对原子质量是小数,是由于元素具有同位素
B. 有相同质子数的原子或离子一定属于同种元素
C. K+和Ar具有相同的电子层结构,氧化性K+比Ar强
D. 金属离子的电子层数一定比金属原子的电子层数少
难度: 中等查看答案及解析
-
A. 原子最外层电子数大于3(小于8)的元素一定是非金属元素
B. 某元素的离子的最外层与次外层电子数相同,该元素一定位于第3周期
C. 最外层电子数比次外层电子数多的元素一定位于第2 周期
D. 原子最外层只有1个电子的元素一定是金属元素
难度: 简单查看答案及解析
-
从宏观方面看物质是由元素组成的,从微观方面看物质是由粒子构成的,下列有关说法不正确的是
A. 质子数等于电子数的微粒,可能是一种分子和一种离子
B. 元素的化学性质主要取决于元素原子的最外层电子数
C. 只由一种分子构成的物质定是纯净物
D. 元素原子的多样性是由构成原子的质子和中子数目引起的
难度: 简单查看答案及解析
-
科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N2H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子不能被植物吸收。下列有关说法不正确的是( )
A. N4和N2互为同素异形体
B. 14N与14C互为同位素
C. N4H4(SO4)2不能与草木灰混合使用
D. 8NH3+4C5OH=N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子
难度: 中等查看答案及解析
-
下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子
后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是( )
A
B
C
D
NH3
C2H4
CCl4
CO2
难度: 中等查看答案及解析
-
最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羧基硫(COS),已知羧基硫分子中所有原子均满足8电子结构,结合已学知识,判断有关说法正确的是
A. 羰基硫分子的电子式为:
B. 羰基硫分子的中心原子为氧
C. 羰基硫中三个原子处于同一直线上
D. 羰基硫是非极性分子
难度: 中等查看答案及解析
-
下列分子或离子中键角由大到小排列顺序是
①BF3 ②NH3 ③H2O ④NH4+ ⑤BeCl2
A.⑤④①②③ B.⑤①④②③
C.④①②⑤③ D.③②④①⑤
难度: 中等查看答案及解析
-
已知[Co(NH3)6]3+的立体结构如图,其中数字处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等,Co3+离子位于八面体的中心。若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2] +同分异构体的种数为

A.2 种 B.3 种 C.4 种 D.5种
难度: 中等查看答案及解析
-
室温时,向20 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生,且混合溶液的体积可看成混合前两溶液的体积之和),下列说法不正确的是:
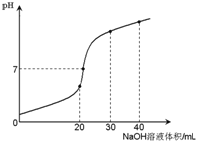
A. pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B. 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中 c(SO42-)+ c(H+)= c(NH3·H2O) + c(OH-)
D. 滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol·L-1
难度: 困难查看答案及解析
-
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化的情况如图甲所示。图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图甲中t0~t1阶段c(B)未画出。
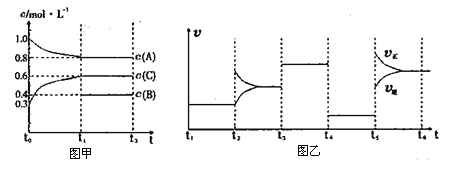
下列说法不正确的是
A. 该反应为吸热反应
B. B 在t0~t1阶段的转化率为60%
C. t4~t5阶段改变的条件为减小压强
D. 此温度下该反应的化学平衡常数K=0.84
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 常温下,10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B. 常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小
C. 在0.1 mol•L-1CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+)
D. 常温下pH = 4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
难度: 中等查看答案及解析
-
25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液的叙述不正确的是。

A. pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+ c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH 的电离常数
D. pH=4 的溶液中: c(H+)+ c(Na+)+c(CH3COOH)=0.1mol/L
难度: 中等查看答案及解析
-
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池反应通常表示为LaNi5H6+6NiO(OH)==LaNi5+6Ni(OH)2。下列说法正确的是
A. 放电时储氢合金作正极
B. 放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+
C. 充电时阳极周围C(OH-)减小
D. 充电时储氢合金作负极VO2++2H++e—=VO2+ +H2O
难度: 中等查看答案及解析
-
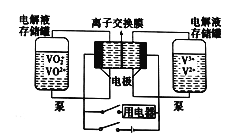
液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图。两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环。下列说法不正确的是( )

A.充电时阴极的电极反应是V3++e-=V2+
B.放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被氧化
C.若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol
D.若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐
难度: 困难查看答案及解析


