-
环保意识是重要的公民意识。下列气体不属于空气质量日报监测指标的是
A.SO2 B.CO C.N2 D.NO2
难度: 简单查看答案及解析
-
下列关于物质用途的说法中,不正确的是
A. 氨可用作制冷剂
B. 二氧化硫可用于杀菌消毒
C. Fe3O4可用于做红色涂料
D. 碳酸氢钠可用作面粉发酵
难度: 简单查看答案及解析
-
下列气体是黄绿色的是
A. CO2 B. Cl2 C. NH3 D. NO
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是
A. 氢氧化铁胶体 B. 乙醇溶液 C. 氯化钠溶液 D. 蔗糖溶液
难度: 简单查看答案及解析
-
下列物质难溶于水的是
A. MgSO4 B. NH4Cl
C. AgNO3 D. BaCO3
难度: 简单查看答案及解析
-
下列物质在水中不能发生电离的是
A. 铜 B. 碳酸钠固体
C. 氯化氢气体 D. 氢氧化钾固体
难度: 简单查看答案及解析
-
砒霜是一种剧毒物质,其主要成分是三氧化二砷(As2O3),根据化学式中元素组成可判断As2O3属于
A. 酸 B. 碱 C. 酸性氧化物 D. 碱性氧化物
难度: 简单查看答案及解析
-
下列反应中,不能体现酸的通性的反应是
A. Fe+H2SO4=FeSO4+H2↑
B. AgNO3+HCl=AgCl↓+HNO3
C. CaO+2HNO3=Ca(NO3)2+H2O
D. C + 2H2SO4(浓)
CO2↑+2SO2↑+2H2O
难度: 简单查看答案及解析
-
下列反应不属于氧化还原反应的是
A. Cl2+2KBr=Br2+2KCl
B. 2NH4Cl + Ca(OH )2
CaCl2 +2NH3↑+ 2H2O
C. 3Mg+N2
Mg3N2
D. 2Na2O2+2CO2=2Na2CO3+O2
难度: 简单查看答案及解析
-
下列变化中,需加入适当的还原剂才能完成的是
A. Cl-→Cl2 B. FeCl2 → FeCl3 C. CuO →Cu D. CO2→ Na2CO3
难度: 简单查看答案及解析
-
下列各组离子能在溶液中大量共存的是
A.K+、H+、
、OH―
B.Na+、H+、
、Cl-
C.Na+、Ca2+、
、
D.Na+、K+、Cl―、
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 硫酸和氢氧化钡溶液混合:H++OH-=H2O
B. 铜与浓硫酸: Cu + 2H+ =Cu2+ + H2↑
C. 银片插入硝酸铜溶液中:Cu2++2Ag = Cu+2Ag+
D. 大理石与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
难度: 简单查看答案及解析
-
某试剂瓶上贴有如下标签,对该试剂理解正确的是

A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0 mol/L Na2SO4溶液的c(Na+)相等
难度: 简单查看答案及解析
-
下列叙述不正确的是
选项
事实
原因
A
钠保存在煤油中
钠在空气中会发生变化
B
钠露置在空气中,迅速变暗
钠与氧气反应生成过氧化钠
C
钠与水反应后滴入酚酞试剂,溶液变红
有碱性物质生成
D
钠在加热条件下能与氧气反应生成淡黄色固体
钠有还原性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列溶液中能用来区别SO2和CO2的是
①石灰水 ②酸性KMnO4 ③氯水④品红溶液⑤紫色石蕊试液
A. ③④⑤ B. ①②③ C. ①⑤ D. ②③④
难度: 简单查看答案及解析
-
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述不正确的是
A. AlN中N元素显-3价
B. 上述反应中,Al2O3是氧化剂
C. 上述反应中N2被还原
D. 上述反应中碳发生氧化反应
难度: 简单查看答案及解析
-
下列实验不能达到目的的是
A. 用Na2O2与水反应制氧气
B. 用Cl2与Ca(OH)2反应制备漂粉精
C. 向某无色溶液中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,以证明原溶液中含有SO42-
D. 向某溶液加入NaOH并微热,产生使湿润的红色石蕊试纸变蓝的气体,以证明原溶液中有NH4+
难度: 中等查看答案及解析
-
下列实验操作、实验现象、解释或结论不对应的是
选项
实验操作
实验现象
解释或结论
A
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
产生大量白烟
氨气与氯化氢反应生成固体物质
B
常温下,将洁净的铁片放入浓硫酸或浓硝酸中
无明显变化
常温下,浓硫酸、浓硝酸使铁片钝化
C
在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
D
向某无色溶液中滴加盐酸
产生能使澄清石灰水变浑浊气体
说明溶液中一定含有CO32-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1 mol O2所占体积约为22.4 L
B. 40 g SO3中含有的分子数约为3.01×1023
C. 1 mol NH3的质量为10 g
D. 标准状况下,22.4 L H2中所含原子数约为6.02×1023
难度: 简单查看答案及解析
-
氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料。自然界中存在如下图所示的氮元素的循环过程,下列说法不正确的是
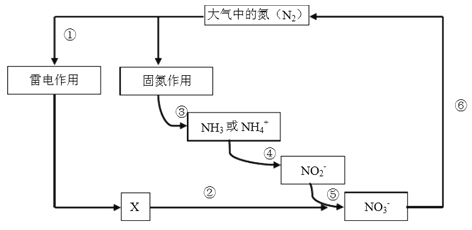
A. 过程①“雷电作用”中发生的反应是:N2 + O2 === 2NO
B. 过程③ “固氮作用”中,氮气被还原
C. ⑤中涉及的反应可能有: 2 NO2‑ + O2 === 2 NO3‑
D. ⑥中涉及的反应可能有: 2NO3- + 12H+ === N2+ 6H2O
难度: 中等查看答案及解析
-
碘在自然界中有很多存在形式,在地壳中主要以NaIO3 形式存在,在海水中主要以I-形式存在,几种粒子与Cl2之间有以下转化关系:
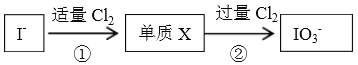
以下说法不正确的是
A. ①中发生的反应是:2I-+Cl2=I2+2Cl-
B. I-与过量Cl2发生的反应是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反应中,氯气都体现氧化性,具体表现为:氯元素由0价降低为-1价
D. 通过以上信息,可预测:若在加入淀粉的KI溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象
难度: 中等查看答案及解析