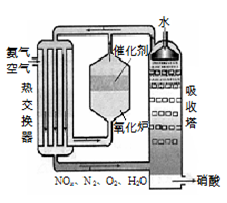
-
化学与能源、环境、生产、生活密切相关,下列说法不正确的是
A.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
B.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
C.利用工业生产产生的二氧化碳可制造全降解塑料
D.用K2FeO4取代Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
难度: 中等查看答案及解析
-
氯化钠是一种重要的化工原料。下列表述中正确的是
A.NaCl的电子式为
B.电解熔融氯化钠可得到氯气和金属钠
C.23Na37Cl中质子数和中子数之比是8:7
D.由NaCl制备纯碱时发生了氧化还原反应
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2↑
B.Cl2溶于水: Cl2+H2O=2H++Cl-+ClO-
C.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列说法不正确的是
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.现代常用红外光谱仪、核磁共振仪研究有机化合物的结构
D.MgO、Al2O3的熔点很高,工业上用于制作耐高温材料,也用于冶炼镁、铝金属
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.1mol羟基与17gNH3所含电子数都为NA
B.12.4g白磷(分子式为P4)中含有P—P共价键0.6 NA
C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
D.适量铜粉溶解于1L0.5mol·L-1稀硝酸中,当生成2.24LNO时,溶液中氮原子数为0.4 NA
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
B.中性溶液:Fe3+、Al3+、NO3-、SO42-
C.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
D.常温下由水电离出的c(H+)=10-10mol·L-1的溶液:Na+、Cl-、ClO-、SO32-
难度: 中等查看答案及解析
-
下列实验原理、装置、试剂选用、结论正确的是
A.用湿润的pH试纸测定稀盐酸的pH
B.用下图1构成锌—铜原电池
C.用下图2根据有关实验现象推知酸性:CH3COOH>H2CO3>C6H5OH
D.用下图3验证溴乙烷发生消去反应生成烯烃


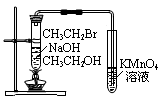
图1 图2 图3
难度: 中等查看答案及解析
-
下列叙述正确的是
A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
B.2SO2(g) + O2(g)
2SO3(g)的正、逆反应的平衡常数K随温度的变化可用右图表示
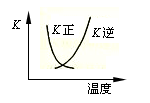
C.2NO+2CO
2CO2+N2 的△H<0,则该反应一定能自发进行
D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大
难度: 中等查看答案及解析
-
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是

A.1mol洋蓟素最多可与6mol Br2反应
B.结构中有2个手性碳原子
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与9mol NaOH反应
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论正确的是
编号
实验操作
实验目的或结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中不一定含有SO42-
B
用洁净的Pt蘸取某溶液进行焰色反应,火焰呈黄色
该溶液中一定含有Na+,无k+
C
将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀
CH3CH2Br未发生水解
D
将打磨过的Al片投到一定浓度的CuCl2溶液,出现气泡并有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解
Al与CuCl2溶液反应,生成了H2和Cu(OH)2
难度: 中等查看答案及解析
-
Li-Al/FeS电池是一种正在开发的电动车用电池,该电池反应式为:
2Al+6Li++3FeS=2Al3++3Li2S+3Fe。有关该电池的下列说法中,正确的是
A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化
B.Li-Al在电池中作为负极材料,负极的电极反应式为Li-e-=Li+
C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS
难度: 中等查看答案及解析
-
室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是
A.水电离出的H+的浓度是1.0×10-4 mol·L-1
B.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3)
C.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
D.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-)
难度: 中等查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质不一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
难度: 中等查看答案及解析
-
在溶液中,反应A+2B
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1c(B)=0.200 mol·L-1 c(C)=0 mol·L-1。反应物A的浓度随时间的变化如右图所示。
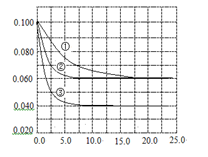
A.若反应①、②的平衡常数分别为K1、K2,则K1< K2
B.反应A+2B
C的△H>0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 mol·L-1
难度: 中等查看答案及解析



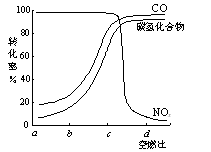
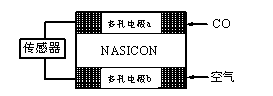

 ,
,