-
在下列溶液中通入CO2至过量,原溶液一直保持澄清的是 ( )
A.硅酸钠溶液 B.氯化钡溶液 C.石灰水 D.漂白粉溶液
难度: 中等查看答案及解析
-
我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A. 第三周期第IA族 B. 第四周期第IA族
C. 第五周期第IA族 D. 第二周期第IIA族
难度: 中等查看答案及解析
-
ClO2 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 △ 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A.1mol KClO3 参加反应有2mol电子转移 B.ClO2是氧化产物
C.H2C2O4的氧化性强于ClO2的氧化性 D.KClO3 在反应中得到电子,作氧化剂
难度: 困难查看答案及解析
-
是重要的核工业原料,在自然界的含量很低。
的浓缩一直为国际社会关注。下列有关
的说法正确的是( )
A.
原子核中含有92个中子 B.
原子核外有143个电子
C.
与
互为同位素 D.
与
互为同素异形体
难度: 简单查看答案及解析
-
下列叙述错误的是( )
A. 水晶顶链是硅酸盐制品 B. 臭氧可作为自来水消毒剂
C. 漂白粉可作环境和游泳池的消毒剂 D. 硅胶可作为食品的干燥剂
难度: 简单查看答案及解析
-
下列关于氯元素的说法正确的是( )
A. HCl具有很强的酸性,且只有氧化性没有还原性
B.
、
为不同的核素,有完全不同的化学性质
C. 1.12L含有1 .7NA个质子(NA表示阿伏加德罗常数)
D. 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强
难度: 简单查看答案及解析
-
下列图示中正确的实验操作是( )

A. 海带灼烧成灰 B. 收集氧气 C. 稀释浓硫酸 D. 分离乙醇和氯化钠溶液
难度: 中等查看答案及解析
-
元素周期表是学习化学的重要工具。下列关于元素周期表的说法不正确的是
A.第七周期的最后一个元素为118号元素
B.元素周期表中第1、2纵行又称为s区
C.元素周期表中ⅠA是包含元素种类最多的纵行
D.根据元素周期表可以预测元素的存在及其性质
难度: 简单查看答案及解析
-
国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是
A. 宇航员喝茶时注入的H2O的摩尔质量是18克
B. H2O+Cl2
HCl+HClO这反应属于氧化还原反应
C. 氢的三种同位素1H、2D、3T与16O只能形成三种水分子
D. 在标准状况下,1mol水的体积约是22.4L
难度: 简单查看答案及解析
-
实验室中,从海带中提取I2的实验流程如下图所示,下列说法不正确的是

A:操作①用到的玻璃仪器有:烧杯、玻璃棒、漏斗
B.操作②中需加入氧化剂
C.可以用四氯化碳或酒精代替苯作萃取剂
D.蒸馏I2的苯溶液可获取I2并回收苯
难度: 中等查看答案及解析
-
0.1mol某种金属元素的单质直接与氯气反应后,质量增加7.1g,则这种元素是
A.Na B.H2 C.Fe D.Cu
难度: 中等查看答案及解析
-
下列有关卤素单质及其化合物的说法正确的是
A. 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
B. 卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次增大
C. 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
D. 卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
难度: 简单查看答案及解析
-
下列各组元素中按微粒半径递增顺序排列的是 ( )
A. Li K Na B. Ba2+Ca2+Mg2+ C. Ca2+K+Cl- D. N O F
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等,下图为海水利用的部分过程。
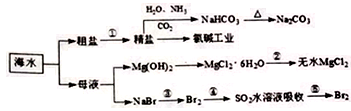
下列有关说法正确的是( )
A. 用澄清石灰水可签别NaHCO3和Na2CO3
B. 从第③步到第⑤步的目的是浓缩
C. 在第③④⑤步中溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
难度: 中等查看答案及解析
-
a、b、c、d、e、f为六种短周期元素,a、b、e、f位于同一周期,c、d也是同一周期,且d、e 同一主族,原子半径d<e,a、b、c、d、f原子最外层电子依次增多,则下列说法中正确的是
A. e的氢化物的沸点一定比d的氢化物的沸点高
B. d元素可能是第一周期元素
C. 六种元素中,a元素最高价氧化物对应水化物碱性最强
D. a、b、c、d的原子序数逐渐增大
难度: 困难查看答案及解析
-
将一盛满Cl2的试管倒立在水槽中,当日光照射相当长一段时间后(充分反应),试管中最后剩余的气体约占试管容积的( )
A. 2/3 B. 1/2 C. 1/3 D. 1/4
难度: 中等查看答案及解析

