-
设NA为阿伏加德罗常数的数值。下列说法正确的是(相对原子质量:H 1 N 14)
A.1L0.1mol·L-1Na2CO3溶液中含有0.1NA个CO32—
B.常温常压下,11.2L甲烷含有共价键数为2NA
C.17gNH3中含有3NA个氢原子
D.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
难度: 简单查看答案及解析
-
下列各项化学用语表达正确的是 ( )
A.NaCl的电子式:
B.次氯酸的结构式:H—Cl—O
C.CO2的分子模型示意图:
D.O2-的离子结构示意图:
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.标准状况下,11.2 LCCl4含有的分子数目为0.5NA
B. 在常温常压下,1mol氦气所含原子数为2NA
C. 10g重水(D2O)里含有的电子数为10NA
D.标准状况下,22.4 LNO2气体含有的分子数目小于NA
难度: 简单查看答案及解析
-
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度为( )
A.0.4 mol/L B.0.3 mol/L
C.0.2 mol/L D.0.1 mol/L
难度: 简单查看答案及解析
-
下列各组离子在无色透明溶液中能大量共存的是
A.K+、HCO
、I-、Na+ B.H+、Br-、NO
、Ag+
C.Na+、MnO
、SO
、K+ D.Na+、CO
、Cl-、H+
难度: 简单查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是( )
A.Na2O、MgO、Al2O3均属于碱性氧化物
B.石灰石、生石灰、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示
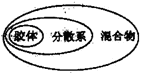
难度: 简单查看答案及解析
-
下列叙述正确的是
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g/mol
C.1 g H2和1 g N2所含分子数相等
D.阿伏伽德罗常数个钠原子的质量是23g
难度: 简单查看答案及解析
-
现将足量的CO2气体不断通入到含KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )

A B

C D
难度: 简单查看答案及解析
-
下列离子方程式与所述事实不相符的是( )
A.苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
B.在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-== BaCO3↓+H2O
C.用新制的氢氧化铜悬浊液检验乙醛中的醛基:
CH3CHO + 2Cu(OH)2 + OH-
CH3COO-+ Cu2O↓ + 3H2O
D.向Ca(ClO)2溶液中通入过量SO2:Ca2++ 2ClO— +SO2+H2O=CaSO4↓+2H++ Cl—+ HClO
难度: 简单查看答案及解析
-
某无色溶液中可能含有I-、NH4+ 、Cu2+、SO32 -(还原性SO32 -大于I-),向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是 ( )
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32 -;④可能含有I-
难度: 简单查看答案及解析
-
下列电离方程式的书写正确的是( )
A. 2H2O
H3O++OH- B. NaHCO3====Na++H++
C. NaHSO4
Na++H++
D. H2S
2H+ + S2-
难度: 简单查看答案及解析
-
下列关于“电解质”相关知识的叙述正确的是( )
A. 在强电解质的水溶液中只有离子没有分子 B. 二氧化碳是弱电解质
C. 难溶的化合物不一定是弱电解质 D. 卤化氢(HX)均为强电解质
难度: 简单查看答案及解析
-
把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式说法正确的是
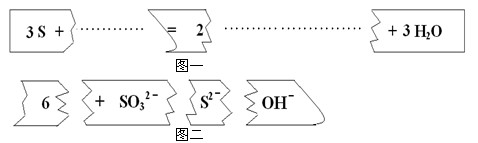
A.配平后的化学计量数依次为3、1、2、6、3
B.若有1mol的S被氧化,则生成2mol S2-
C.氧化剂与还原剂的物质的量之比为1:2
D.2mol的S参加反应有3mol的电子转移
难度: 简单查看答案及解析
-
已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,据此判断下列说法正确的是( )
A.反应生成物都属于电解质 B.HCl全部发生氧化反应
C.该反应表明氧化性KClO3比Cl2强 D.1mol KClO3在反应中得到6mole-
难度: 简单查看答案及解析
-
火药的爆炸反应为:2KNO3+S+3C====K2S+N2↑+3CO2↑,其中被还原的元素是
A、N B、N和S C、N和C D、C
难度: 简单查看答案及解析
-
已知下列反应①
;②
;
③
试判断下列物质的氧化性强弱顺序正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
