-
某合作学习小组讨论辨析以下说法 ,其中说法正确的是
①纯碱和熟石灰都是碱。 ②沼气和水蒸气都是可再生能源;
③冰和干冰既是纯净物又是化合物; ④硫酸和食醋既是化合物又是酸;
⑤不锈钢和目前流通的硬币都是合金; ⑥粗盐和酸雨都是混合物。
A.③⑤⑥ B.②④⑥ C.①③⑤ D.①②③⑥
难度: 简单查看答案及解析
-
阿伏加德罗常数为NA,下列说法中正确的是
A.62 g Na2O溶于水后所得溶液中含有的O2-数为NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl—总数大于3NA
C.常温常压下, 16 g甲基(—13CH3)所含的中子数为10NA
D.0.5mol Cu和足量浓硝酸反应可以生成22.4LNO2
难度: 简单查看答案及解析
-
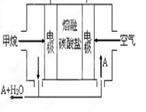
关于下列各实验装置的叙述中,不正确的是
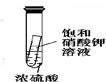
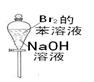
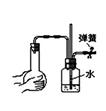
① ② ③ ④
A.装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
B.实验②放置一段时间后,小试管内有晶体析出
C.实验③振荡后静置,上层溶液颜色变浅
D.实验④不能用来检查装置的气密性
难度: 简单查看答案及解析
-
常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
C.pH=4的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-)
D.将pH=6的H2SO4稀释1000倍后,c(H+)="2" c(SO42-)
难度: 简单查看答案及解析
-
在甲、乙两烧杯溶液中,分别含有大量的
、
、
、
、
、
6种离子中的3种,已知乙烧杯的溶液呈黄色,则甲烧杯的溶液中大量存在的离子是
A.
、
、
B.
、
-、
C.
、
、
D.
、
、
难度: 简单查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是
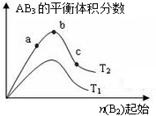
A.达到平衡时,AB3的物质的量大小为:c>b>a
B.达到平衡时,A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是放热反应
D.a点的化学平衡常数小于c点的化学平衡常数
难度: 简单查看答案及解析
-
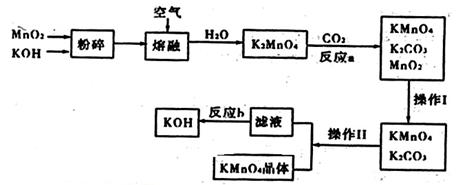
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:
方案Ⅱ:
下列有关判断中不正确的是
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案II更便于实施
难度: 简单查看答案及解析