-
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
A.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可以用过滤的方法除去
D.高纯度的二氧化硅用于制作光导纤维,光导纤维遇强碱溶液会“断路”
难度: 中等查看答案及解析
-
将淀粉与KCl的混合液装在半透膜中,浸泡在装有蒸馏水的烧杯中,过一段时间后,取烧杯中液体进行实验,能证明半透膜有破损的是
A.加入碘水不变色 B.加入碘水变蓝色
C.加入AgNO3 溶液不产生白色沉淀 D.加入AgNO3 溶液产生白色沉淀
难度: 中等查看答案及解析
-
对溶液中的离子反应存在下列几种说法,其中正确的是
A.不可能是氧化还原反应 B.只能是复分解反应
C.可能是化合反应 D.不可能是置换反应
难度: 中等查看答案及解析
-
下列溶液中的Cl-物质的量与100ml 1 mol·L-1AlCl3溶液中Cl-相等的是
A.150ml 1 mol·L-1氯化钠溶液 B.75ml 2 mol·L-1氯化镁溶液
C.50ml 3mol·L-1氯化钾溶液 D.50ml 1 mol·L-1氯化铁溶液
难度: 中等查看答案及解析
-
在溶液中能大量共存的一组离子或分子是
A.NH4+ 、H+、NO3-、HCO3- B.K+ 、Al3+、SO42-、NH3·H2O
C.Na+、K+、SO32-、Cl2 D.Na+ 、CH3COO-、CO32-、OH-
难度: 中等查看答案及解析
-
下列叙述正确的是
A.元素的单质一定是由氧化或还原该元素的化合物制得
B.含有最低价元素的化合物不一定具有很强的还原性
C.阳离子只能得电子被还原,阴离子只能失电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,22.4LCCl4含有NA个分子
B.常温常压下46gNO2和N2O4混合气体含有3NA个原子
C.0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子
D.0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA
难度: 中等查看答案及解析
-
下列与实验相关的叙述正确的是
A.稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.配制1 mol·L-1300mLNaCl溶液可以选择一个50mL的容量瓶和一个250 mL的容量瓶
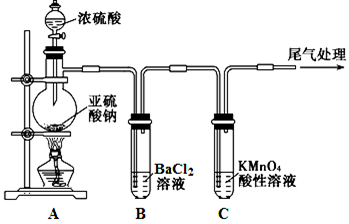
D.可以用下图装置进行氯气的尾气处理
难度: 中等查看答案及解析
-
对于Cl2+SO2+2H2O =H2SO4+2HCl反应,下列说法正确的是
①Cl2是氧化剂 ②SO2被氧化 ③Cl2被氧化 ④Cl2发生还原反应
⑤SO2具有还原性 ⑥Cl2具有氧化性
A.只有①②⑥ B.只有②③④ C.只有②④⑤⑥ D.只有①②④⑤⑥
难度: 中等查看答案及解析
-
下列做法存在安全隐患或导致实验失败的是
A.将1mol·L-1FeCl3溶液滴入沸水中制备Fe(OH)3胶体
B.氢气还原氧化铜实验中,先通氢气后加热氧化铜
C.将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液中
D.用烧瓶加热液体时投入碎瓷片以防暴沸
难度: 中等查看答案及解析
-
下列反应的离子方程式表示正确的是
A.澄清石灰水中通入过量二氧化碳:OH-+CO2 =HCO3-
B.铜片跟三氯化铁溶液反应:Fe3++Cu =Cu2++Fe2+
C.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O =CaSO3↓+2HClO
D.Fe3O4与稀HNO3反应:Fe3O4+8H+ =Fe2++2Fe3++4H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强
B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为:
Fe3+ > Cu2+ > Fe2+
C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C- + B2 = 2B- +C2都能发生
D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
难度: 中等查看答案及解析
-
NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为
A.224mL B.336mL C.448mL D.672mL
难度: 中等查看答案及解析
-
下列关于氧化物的叙述不正确的是
①非金属氧化物不一定属于酸性氧化物
②酸性氧化物都属于非金属氧化物
③金属氧化物都属于碱性氧化物
④碱性氧化物都属于金属氧化物
⑤酸性氧化物都能与水反应生成相应的含氧酸
⑥两性氧化物既能与酸也能与碱反应生成盐和水
⑦与水反应生成含氧酸的氧化物一定是酸性氧化物
⑧不能与酸反应的氧化物一定能与碱反应
A.①②③⑥⑧ B.②③⑤⑦⑧ C.②③⑤⑥⑦ D.②③④⑥⑧
难度: 中等查看答案及解析
-
常温下,下列各组离子在给定条件下能大量共存的是
A.在pH=1的溶液中:NH4+、K+、Ba2+、Cl-
B.在滴加石蕊试液显红色的溶液中:K+、NH4+、CO32-、SO42-
C.有NO3-存在的溶液中:H+、Ba2+、Cl-、SO32-
D.在c (H+)=1.0×10-3mol·L-1的溶液中:Na+、K+、SO42-、[Al(OH)4]一
难度: 中等查看答案及解析
-
下列说法正确的是
①用丁达尔效应可以区分食盐水和淀粉溶液
②标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4 L
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④由CaCO3的溶解度小于Ca(HCO3)2,可推出Na2CO3的溶解度小于NaHCO3
⑤在使Al溶解产生H2的溶液中能大量存在:NH4+、Na+、Fe2+、NO3-
⑥一种盐和另外一种盐反应不一定生成两种新盐
A.①⑤ B.①④ C.③⑥ D.①⑥
难度: 中等查看答案及解析