-
“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:
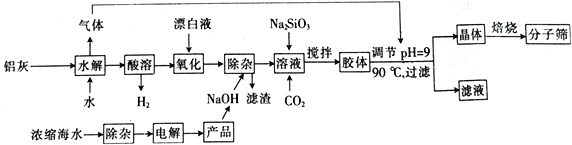
(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式),该气体分子中极性键的数目为___________;“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:

①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
-
碳热还原法广泛用于合金及材料的制备。回答下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+ 15C+5N2==2Al23O27N5+15CO,产物Al23O27N5中氮的化合价为______________________________。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3 (s)+ 3C(s)==Al2OC(s)+2CO(g) △H1
2Al2OC(s) + 3C(s)==Al4C3(s) + 2CO(g) △H2
2Al2O3 (s)+ 9C(s)== Al4C3 (s) + 6CO(g) △H3
①△H3=_________ (用△H1、△H2 表示)。
②Al4C3可与足量盐酸反应制备一种最简单的烃,该反应的化学方程式为__________________________。(3)下列是碳热还原制锰合金的三个反应,CO 与CO2 平衡分压比的自然对数值(1nK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数。分压=总压× 气体的物质的量分数)。
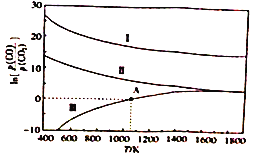
I.Mn3C(s)+4CO2(g)  3MnO(s)+5CO(g) Kp(I)
3MnO(s)+5CO(g) Kp(I)
II.Mn(s)+CO2(g)  MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)
III.Mn3C(s) + CO2(g)  3Mn(s)+2CO(g) Kp(III)
3Mn(s)+2CO(g) Kp(III)
①△H>0 的反应是__________________ (填“I”“II”或“I”)。
②1200 K时,在一体积为2L的恒容密闭容器中有17.7 gMn3C(s)和0.4molCO2,只发生反应I,5min后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min 内V(CO2)=____________。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应II,下列能说明反应II达到平衡的是____________ (填字母 )。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C 并充入0.1molCO2,若只发生反应III,则在A点反应达到平衡。当容器的总压为a kPa时,CO2的转化率为______________;A点对应温度下的Kp(III)=____________。
-
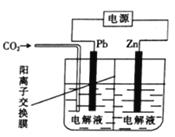
NiCl2是化工合成中最重要的镍源。实验室常用下列装置(夹持装置已略去)制备无水NiCl2。

实验步骤如下 :
I.按图示连接好装置,检查装置气密性后,先向装置中通入干燥的CO2。
II.约20 min后,停止通入CO2,改为通儒Cl2 并使装置中充满Cl2。
III.将电炉升温至750℃,在氯气流中加热约lh。
IV.在氯气流中冷却至室温后,再继续通入CO 2约10 min。
回答下列问题:
(1)仪器A的名称为_____________________________。
(2)步骤I中通入CO2 的目的是___________________________。
(3)A中生成Cl2 的离子方程式为______________________________________。
(4)判断步骤II中氧气已充满装置的现象是______________________________________。
(5)步骤IV中通入CO 2的目的是______________,水槽中NaOH 溶液的作用是_____________________。
(6)反应前石英管及瓷舟的总质量为m1、放入镍粉后石英管及瓷舟的总质量为m2,氧化反应后石英管及瓷舟的总质量为m3,则产品中n(Ni)/n(Cl)=________(填计算表达式)。
(7)实验室也可用NiCl2·6H2O 与液态SOCl2 混合加热制取无水NiCl2,其反应的化学方程式为______________________。
-
(题文)世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_________(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_________________,Q2+的未成对电子数是______。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是________________,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_____________________。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_______ (填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是________,写出一种与SO42-互为等电子体的分子的化学式:__________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示,则该化合物的化学式为_________。若该晶体的密度为pg.Cm-3,则该晶体内铜离子与氧离子间的最近距离为_____________(用含p的代数式表示,其中阿伏加德罗常数用NA表示)cm。

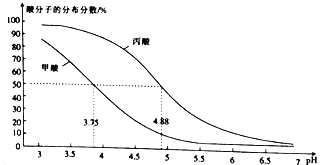
CH3CH2COO-+ H+ 的lgK=-4.88





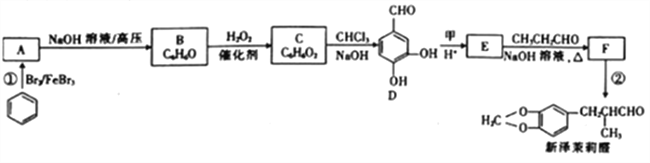
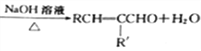

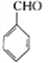 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备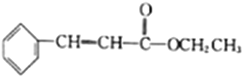 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。