-
500mL含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl-为1.8mol,Na+为2mol,Mg2+为0.5mol,则SO42-的物质的量浓度为
A.0.6mol /L B.0.7mol /L C.1.2mol /L D.1.0mol /L
难度: 简单查看答案及解析
-
2015年8月12日天津港一处集装箱码头发生爆炸事故,造成大批人员伤亡,事故原因是违规存放爆炸物品。下列图标警示的是爆炸物品的是
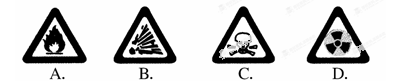
难度: 简单查看答案及解析
-
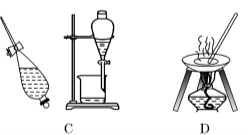
下列实验中,①pH试纸的使用 ②过滤 ③蒸发 ④配制一定物质的量浓度溶液,均用到的仪器是
A.蒸发皿 B.玻璃棒 C.试管 D.分液漏斗
难度: 中等查看答案及解析
-
“纳米材料”是指微粒直径为几纳米到几十纳米的材料,如将纳米材料分散到水中,得到的分散系不可能具有的性质有下列的
A.能全部透过半透膜 B.能全部通过滤纸
C.粒子做布朗运动 D.有电泳现象
难度: 简单查看答案及解析
-
下列物质中,前者属于纯净物,后者属于混合物的是
A.净化后的空气;液态氯化氢
B.水和冰混合;澄清石灰水
C.生锈的铁钉;高锰酸钾充分加热后的剩余固体
D.氯化钾;四氧化三铁
难度: 中等查看答案及解析
-
实验中的下列操作正确的是
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.粗盐提纯时,为了加快过滤速率,可以用玻璃棒进行搅拌
C.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.含有NA个氢原子的气体的体积约为11.2L
B.25℃,101×105 Pa,40g SO3含有的原子数为2NA
C.28g铁与足量盐酸反应转移电子数为1.5NA
D.1mol/L NaOH溶液中含有的Na+数为NA
难度: 中等查看答案及解析
-
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做实验时,某同学取用硝酸溶液后,应把它放回的位置是
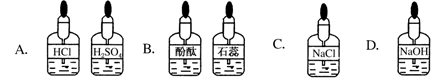
难度: 中等查看答案及解析
-
下列各种粒子,在氧化还原反应中通常只可作为氧化剂使用的是
A.SO32- B. MnO4- C.Cl- D.Fe
难度: 简单查看答案及解析
-
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是
A.Ca2+、Na+、NO3-、CO32-
B.Mg2+、Cl-、NH4+、SO42-
C.K+、Cl-、HCO3-、NO3-
D.Ca2+、Na+、Fe3+、NO3-
难度: 中等查看答案及解析
-
下列反应的现象描述与离子方程式都正确的是
A.金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-=MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成Ba2++SO42-=BaSO4↓
C.碳酸镁与盐酸反应:有气泡逸出CO32-+2H+=CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
下列变化中需加入氧化剂才能实现的是
A.H2S→SO2 B.Fe2+→Fe C.CO32-→CO2 D.2H+→H2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.没有单质参加的反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.失电子难的原子,容易获得电子
难度: 简单查看答案及解析
-
关于金属的下列说法错误的是
A.钠在空气中燃烧时,先熔化,再燃烧,最后所得产物为Na2O2
B.一定条件下,铁粉可与水蒸气反应
C.铝因在空气中形成的一薄层致密氧化膜对铝有保护作用,使得性质比较活泼的金属铝成为一种应用广泛的金属材料
D.铝与氢氧化钠溶液反应,氢氧化钠和水都是氧化剂
难度: 简单查看答案及解析
-
下列对实验过程的评价正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3
B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42-
C.某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性
D.验证溶液中是否含有Cl-,先加稀盐酸酸化,再加硝酸银溶液,有白色沉淀出现,证明含Cl-
难度: 中等查看答案及解析
-
已知X2、Y2、Z2、W2四种物质的氧化能力强弱顺序为:W2>Z2>X2>Y2,判断下列氧化还原反应,能够发生的是
A.2W-+Z2=2Z-+W2
B.2X-+Y2=2Y-+X2
C.2Y-+W2=2W-+Y2
D.2Z-+X2=2X-+Z2
难度: 中等查看答案及解析
-
已知aM2++bO2+4H+===cM3++dH2O,则化学计量数c的值为
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂即可鉴别出来,鉴别的先后顺序是
A.③④②① B.③④①② C.②①③④ D.④③①②
难度: 中等查看答案及解析
-
金属钛(Ti)的机械强度高,抗腐蚀能力强,有“未来金属”之称。以TiO2制金属钛,主要反应有:①TiO2+2C+2Cl2
TiCl4+2CO;②TiCl4+2Mg
2MgCl2+Ti
下列叙述不正确的是
A.反应①中碳是还原剂
B.反应①中TiO2是氧化剂
C.反应②表现了金属镁还原性比金属钛强
D.反应①中氧化剂与还原剂物质的量之比为1∶1
难度: 中等查看答案及解析
-
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+ Sn2++2Fe3+===2Fe2++Sn4+
由此可确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ce3+
B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe2+、Sn2+、Ce3+
难度: 中等查看答案及解析
-
一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
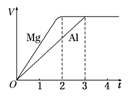
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
难度: 中等查看答案及解析