-
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
A.水可以电离出离子,所以是强电解质
B.水的离子积可表示KW=c(H+)·c(OH-)
C.常温下水中的c(H+)大于c(OH-)
D.升高温度,c(H+)增大,显弱酸性
难度: 中等查看答案及解析
-
下列物质的有关事实与电化学腐蚀无关的是
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀
D.在空气中,金属镁、铝的表面可形成一层氧化膜
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.拆开物质中的化学键一定需要吸收能量
C.应用盖斯定律,无法计算某些难以直接测量的反应焓变
D.化学反应都伴随着能量变化和其他各种现象的出现
难度: 简单查看答案及解析
-
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是
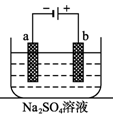
A.a电极附近呈红色,b电极附近呈蓝色
B.a电极附近呈蓝色,b电极附近呈红色
C.逸出气体的体积,a电极的大于b电极的
D.a、b两电极都逸出无色无味气体
难度: 中等查看答案及解析
-
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
A.中和碱的能力相同 B.盐酸和醋酸的物质的量浓度相同
C.OH-的物质的量浓度相同 D.H+的物质的量浓度不同
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0,降低温度产生的影响为
A. v正 增大,v逆减小 B.v正减小,v逆增大
C. v正和v逆同程度的减小 D. v正和v逆不同等程度的减小
难度: 中等查看答案及解析
-
一定条件下反应2AB(g)
A2(g) +B2(g),不能确定达到平衡状态的是
A.单位时间内生成n mol A2,同时生成2n molAB
B.单位时间内生成n mol B2,同时生成2n molAB
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的物质的量分数不随时间变化
难度: 中等查看答案及解析
-
下列各离子方程式中,属于水解反应且使溶液显碱性的是
A.CH3COOH+OH-= CH3COO-+H2O
B.H2O+H2O
H3O++OH-
C.NH4+ + H2O
NH3·H2O + H+
D.PO43-+H2O
HPO42-+OH-
难度: 中等查看答案及解析
-
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
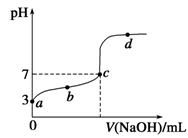
A.a点表示溶液中c(CH3COO-)约为10-3 mol/L
B.b点表示的溶液中c(Na+)>c(CH3COO-)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中
大于K
难度: 中等查看答案及解析
-
下列叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-)
B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生
C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A.强酸性溶液中:K+、Al3+、CH3COO-、SO42-
B.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO
、Br-、Ba2+
C.室温下,pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
难度: 中等查看答案及解析
-
下图各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为

难度: 中等查看答案及解析
-
如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。下列说法中,正确的是

A.燃料电池工作时,正极反应为:O2 + 4H++ 4e-= 2H2O
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出铜的质量相等
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 中等查看答案及解析
-
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是
A.②③ B.③⑥ C.①④ D.⑤⑥
难度: 中等查看答案及解析
-
下列说法错误的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
难度: 中等查看答案及解析
-
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g)(正反应为放热反应)。下列说法错误的是
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是 1∶3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
难度: 中等查看答案及解析
-
对于可逆反应: 2A(g)+B(g)
2C(g) △H<0,下列各图中正确的是

难度: 中等查看答案及解析
-
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)
TaI4(g) + S2(g),下列说法错误的是

A.在不同温度区域,TaI4 的量不同
B.在提纯过程中,S2 的量不断增多
C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大
D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
难度: 中等查看答案及解析
